
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Аналіз будови білків
8.3.1. Аналіз гомологічних білків. Гомологічні білки – білки, які виконують одну й ту саму функцію, але відрізняються за первинною структурою (наприклад, білки, що локалізовані в різних органах чи утворюються при патологічних станах). Наприклад, HbA Þ HbS (замість залишку Glu в 6-му положенні β-ланцюга містить Val) при серпоподібноклітинній анемії.
· Метод пептидних карт (метод відбитків пальців, або дактилографічний аналіз) був запропонований В. Інгремом. Він являє собою поєднання високовольтного електрофорезу та хроматографії на папері. Принцип методу полягає в тому, що білки, які порівнюються, піддають ферментативному гідролізу до пептидів. Найчастіше з цією метою використовують трипсин. Утворену суміш пептидів кожного білка наносять у вигляді плями на куточок аркуша хроматографічного паперу та проводять електрофоретичне розділення фрагментів у горизонтальному напрямку. Пептиди містять у своєму складі різні амінокислоти і відрізняються один від одного за зарядом, отже, під дією електричного поля розміщуються на аркуші хроматографічного паперу у різних зонах. Отриману електрофореграму піддають хроматографії у вертикальному напрямку. Після таких операцій хроматографічний папір обробляють розчином нінгідрину в ацетоні. У результаті нінгідринової реакції пептиди набувають пурпурового кольору. Отримані таким чином “дактилограми” порівнюють за топографією пептидів та роблять висновок про ступінь подібності первинних структур вихідних білків.
8.3.2. Встановлення амінокислотного складу білка. До визначення амінокислотної послідовності виділеного білка бажано мати уявлення про його амінокислотний склад, тобто знати, які амінокислоти і в якій кількості входять до складу його молекули. Для цього проводять повний гідроліз білка з наступним кількісним аналізом амінокислот, що вивільнилися. Найчастіше використовують кислотний гідроліз. Поліпептид розчиняють у 6 N HCl за відсутності кисню, щоб запобігти окисненню сірковмісних амінокислот. Суміш нагрівають до 100-120 °С і витримують при цій температурі упродовж 10- 100 годин. Однак при цьому способі гідролізу деякі амінокислоти (серин, триптофан, тирозин, глутамін, аспарагін) руйнуються. Амінокислотний склад поліпептидного гідролізату визначають шляхом іонообмінної хроматографії з використанням автоматичного амінокислотного аналізатора. Ідентифікують амінокислоти за елюційним об’ємом, а їх кількість визначають за інтенсивністю флуоресценції після проведення реакції з дансилхлоридом.
8.3.3. Визначення N-кінцевої амінокислоти. Метод Сенджера (запропонований у 1945 р.) – вільна непротонована аміногрупа N-кінцевої амінокислоти білка чи пептиду реагує з динітрофторбензолом (ДНФБ) у лужному середовищі з утворенням забарвлених у жовтий колір ДНФ-похідних білка чи пептиду. При подальшому кислотному гідролізі утворюється суміш ДНФ-похідного N-кінцевої амінокислоти та вільних амінокислот, що входять до складу досліджуваного білка. Структура N-кінцевої амінокислоти встановлюється за “свідком” при хроматографуванні ДНФ-похідних еталонних амінокислот.
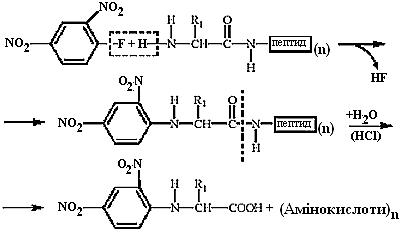 |
Метод має обмежену специфічність. ДНФБ реагує не тільки з α-аміногрупою кінцевої амінокислоти, але й із ε-аміногрупою лізину, SH-групою цистеїну, ОН-групою тирозину, імідазольною групою гістидину. Проте ε-ДНФ-лізин легко відрізнити за допомогою спеціального свідка, а всі решта побічні ДНФ-похідні є безбарвними і не заважають проведенню аналізу на N-кінцеву амінокислоту.
Метод Едмана (запропонований шведським біохіміком П.Едманом у 1950-1956 рр.): до розчину пептиду додають реактив Едмана, що містить фенілізотіоціанат (ФІТЦ), який зв’язується з α-аміногрупою першої N-кінцевої амінокислоти з утворенням фенілтіокарбамоїл (ФТК)-пептиду оранжевого кольору. Після цього відбувається відщеплення в кислому середовищі від ФТК-пептиду фенілтіогідантоїнового (ФТГ)-похідного N-кінцевої амінокислоти та його ідентифікація. Потім зазначені етапи повторюються з наступною N-кінцевою амінокислотою досліджуваного пептиду. Найважливішою перевагою розщеплення за методом Едмана порівняно з іншими методами визначення N-кінцевої амінокислоти є те, що відбувається послідовне вкорочення пептиду з N-кінця на один мономер без руйнування пептидних зв’язків між іншими амінокислотними залишками, що дозволяє з’ясувати амінокислотну послідовність досліджуваного пептиду. Цей процес автоматизований – використовують спеціальний прилад – “секвенатор” (від англ. “sequence” – послідовність), що дозволяє аналізувати з високою ефективністю продукти білкового гідролізу і природні пептиди.
 |
Взаємодія N-кінцевої амінокислоти із дансил-хлоридом (1-диметиламінонафталін-5-сульфохлорид, ДНС) із утворенням ДНС-похідних білків та пептидів. Після подальшого кислотного гідролізу відбувається вивільнення з поліпептидного ланцюга N-кінцевої ДНС-амінокислоти, що має інтенсивну жовту флуоресценцію. Після цього проводять хроматографічну ідентифікацію ДНС-амінокислот.
 |
Ферментативний метод (використання амінопептидаз – це ферменти, які вибірково відщеплюють N-кінцеві амінокислоти). Найбільш вивченим ферментом цього типу є лейцинамінопептидаза. Її виділяють із нирок свиней. За допомогою цього ферменту були встановлені, зокрема, N-кінцеві амінокислоти інсуліну та рибонуклеази. Фермент погано відщеплює N-кінцеві амінокислоти, якщо вони зв’язані з лізином, аргініном та ароматичними амінокислотами.
8.3.4. Визначення С-кінцевої амінокислоти. Метод Акаборі (поліпептид обробляють безводним гідразином при температурі 90 °С упродовж 20-100 годин за наявності іонообмінного сорбенту (як каталізатора). Гідразин реагує з карбонільною групою кожного пептидного зв’язку, розщеплюючи його з утворенням ацилгідразидних похідних усіх амінокислотних залишків, крім С-кінцевого. С-кінцева амінокислота не піддається модифікації, оскільки її α-СООН група не бере участі в утворенні пептидного зв’язку. С-кінцеву амінокислоту ідентифікують хроматографічно після обробки суміші ДНФБ).
Ферментативний метод (карбоксипептидази А відщеплюють ароматичні С-кінцеві амінокислоти, карбоксипептидази В – основні С-кінцеві амінокислоти).
8.3.5. Визначення амінокислотної послідовності білкового ланцюга. Встановлення кінцевих амінокислот у досліджуваному пептиді дозволяє в подальшому визначити всю його амінокислотну послідовність. Для цього, як правило, проводять повторне розщеплення за методом Едмана (як описано вище). Використовують прилад секвенатор, запропонований П. Едманом і Г. Бегом. Секвенатор визначає один амінокислотний залишок за годину. Таким способом можна встановити послідовність розміщення 40-60 залишків амінокислот. Щоб встановити послідовність розміщення амінокислот у великих поліпептидних молекулах, їх піддають розщепленню ферментативним або хімічним шляхом на фрагменти із розмірами, достатніми для проведення секвенування.
9. Коротка історична довідка
1820 р. – виділено першу амінокислоту – гліцин – із кислотного гідролізату желатину (А. Браконно);
1838 р. – уперше проведено систематичні дослідження білків (Г. Мульдер);
1838 р. – запропоновано термін “протеїн” (Я. Берцеліус);
1871 р. – встановлено факт розщеплення білка (казеїну) до амінокислот травними соками (М. Любавін);
1902 р. – відкриття пептидного зв’язку (Е. Фішер);
1910 р. – висунуто ідею про те, що білки побудовані в основному з амінокислот (А. Коссель);
20-ті роки XX ст. – визначення молекулярної маси білків методом ультрацентрифугування (Т. Сведберг);
1935 р. – відкрито треонін – останню з числа незамінних амінокислот (А. Розе);
1948 р. – за розроблення методу електрофорезу у вільній фазі А. Тизеліус нагороджений Нобелівською премією;
1951 р. – сформульовано теорію формування вторинної структури білка – теорію спіралей (Л. Полінг і Р. Корі). Нобелівська премія 1952 р.;
1952 р. – за розроблення методу розподільної хроматографії на папері А. Мартін і Р. Сінг нагороджені Нобелівською премією;
1955 р. – встановлено первинну структуру інсуліну (Ф. Сенджер). Нобелівська премія 1952 р.;
1962 р. – встановлено просторову структуру білків за допомогою рентгеноструктурного аналізу (М. Перутц, Дж. Кендрю).
Не нашли, что искали? Воспользуйтесь поиском: