
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Условие осаждения и растворения осадка
В случае AgCl: AgCl ↔ Ag+ + Cl¯
Ks = [Ag+] • [CI¯]:
а) условие равновесия между осадком и раствором: [Ag+] • [Cl¯] = Ks.
б) условие осаждения: [Ag+] • [Cl¯] > Ks; в ходе осаждения концентрации ионов уменьшаются до установления равновесия;
в) условие растворения осадка или существования насыщенного раствора: [Ag+] • [Cl¯] < Ks; в ходе растворения осадка концентрация ионов увеличивается до установления равновесия.
Координационные соединения
Координационные (комплексные) соединения – соединения с донорно-акцеп-торной связью.
Для K3[Fe(CN)6]:
ионы внешней сферы – 3К+,
ион внутренней сферы – [Fe(CN)6]3-,
комплексообразователь – Fe3+,
лиганды – 6CN¯, их дентатность – 1,
координационное число – 6.
Примеры комплексообразователей: Ag+, Cu2+, Hg2+, Zn2+, Ni2+, Fe3+, Pt4+ и др.
Примеры лигандов: полярные молекулы Н2O, NH3, CO и анионы CN¯, Cl¯, OH¯ и др.
Координационные числа: обычно 4 или 6, реже 2, 3 и др.
Номенклатура. Называют сначала анион (в именительном падеже), затем катион (в родительном падеже). Названия некоторых лигандов: NH3 – аммин, Н2O – акво, CN¯ – циано, Cl¯ – хлоро, OH¯ – гидроксо. Названия координационных чисел: 2 – ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса. Указывают степень окисления комплек-сообразователя:
[Ag(NH3)2]Cl – хлорид диамминсеребра(I);
[Cu(NH3)4]SO4 – сульфат тетрамминмеди(II);
K3[Fe(CN)6] – гексацианоферрат(III) калия.
Химическая связь.
Теория валентных связей предполагает гибридизацию орбиталей центрального атома. Расположение образующихся при этом гибридных орбиталей определяет геометрию комплексов.
Диамагнитный комплексный ион Fe(CN)64-.
Цианид-ион – донор

Ион железа Fe2+ – акцептор – имеет формулу 3d64s04p0. С учетом диамагнитности комплекса (все электроны спарены) и координационного числа (нужны 6 свободных орбиталей) имеем d2sp3 -гибридизацию:
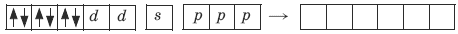
Комплекс диамагнитный, низкоспиновый, внутриорбитальный, стабильный (не используются внешние электроны), октаэд-рический (d2sp3 -гибридизация).
Парамагнитный комплексный ион FeF63-.
Фторид-ион – донор.
Ион железа Fe3+ – акцептор – имеет формулу 3d54s04p0. С учетом парамагнитности комплекса (электроны распарены) и координационного числа (нужны 6 свободных орбиталей) имеем sp3d2 -гибридизацию:

Комплекс парамагнитный, высокоспиновый, внешнеорбитальный, нестабильный (использованы внешние 4d-орбитали), октаэдрический (sp3d2 -гибридизация).
Не нашли, что искали? Воспользуйтесь поиском: