
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Основные классы неорганических соединений
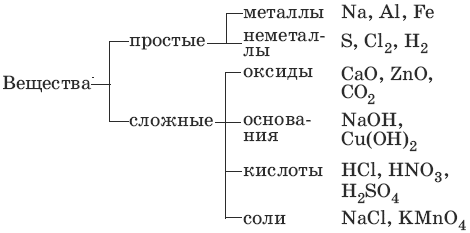
Оксиды
Оксиды – сложные вещества, состоящие из атомов кислорода в степени окисления -2 и атомов другого элемента.
Номенклатура: Fe2O3 – оксид железа(III), Cl2O – оксид хлора(I).
Классификация оксидов
Несолеобразующие (безразличные) оксиды: CO, SiO, NO, N2O.
Солеобразующие оксиды:
основные – оксиды металлов в степени окисления +1, +2,
амфотерные – оксиды металлов в степени окисления +2, +3, +4,
кислотные – оксиды металлов в степени окисления +5, +6, +7 и
оксиды неметаллов в степени окисления +1 – +7.
Получение оксидов
Горение простых веществ:
С + O2 = CO2
2Са + O2 = 2СаО
Горение (обжиг) сложных веществ:
CH4 + 2O2 = CO2 + 2Н2O
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
Разложение сложных веществ:
CaCO3 → t → СаО + CO2
2Fe(OH)3 → t → Fe2O3 + ЗН2O
Химические свойства оксидов
Основным оксидам (Na2O, CaO, CuO, FeO) соответствуют основания.
СаО + Н2O = Са(OH)2 (растворимы оксиды металлов IA– и IIА-групп, кроме Be, Mg)
CuO + Н2O ≠ (оксиды остальных металлов нерастворимы)
СаО + CO2 = CaCO3
СаО + 2HCl = CaCl2 + Н2O
Кислотным оксидам (CO2, Р2O5, СrO3, Mn2O7) соответствуют кислоты.
SO2 + Н2O = H2SO3 (кислотные оксиды, кроме SiO2, растворимы в воде)
SO2 + СаО = CaSO3
SO2 + 2NaOH = Na2SO3 + Н2O
Амфотерным оксидам (ZnO, Al2O3, Cr2O3, ВеО, РЬО) соответствуют амфотерные гидроксиды.
ZnO + H2O ≠ (амфотерные оксиды нерастворимы в воде)
ZnO + 2HCl = ZnCl2 + Н2O
ZnO + 2NaOH → t → Na2ZnO2 + Н2O (при нагревании или сплавлении)
ZnO + 2NaOH + H2O = Na2[Zn(OH)4] (в разбавленном растворе)
Основания
Основания – сложные вещества, состоящие из атомов металла и гидроксиль-ных групп; основания – электролиты, образующие при диссоциации в качестве анионов только анионы гидроксила.
Номенклатура: Fe(OH)3 – гидроксид железа(III).
Классификация оснований:
– растворимые (щелочи) NaOH, KOH;
– нерастворимые Fe(OH)2, Mg(OH)2;
– амфотерные Zn(OH)2, Al(OH)3, Ве(OH)2, Сr(OH)3;
– однокислотные NaOH, KOH;
– двухкислотные Ва(OH)2, Zn(OH)2;
– трехкислотные Al(OH)3, Сr(OH)3.
Не нашли, что искали? Воспользуйтесь поиском: