
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Задачи и упражнения. Пример 1. Рассчитать число моль и количество молекул в 40 г серной кислоты.
Пример 1. Рассчитать число моль и количество молекул в 40 г серной кислоты.
 Дано: Решение:
Дано: Решение:
m(H2SO4) = 40 гМ(H2SO4) = 2·2 + 32 + 4·16=98 г/моль.
 1. 1 моль весит 98 г
1. 1 моль весит 98 г
ν(H2SO4) =? ν моль – 40 г:
N (H2SO4) =?
ν(H2SO4) =  = 0,408 моль.
= 0,408 моль.
2. В 1 моль вещества содержится число Авогадро Na = 6,02·1023молекул, отсюда 0,408 моль содержат N молекул:
N (H2SO4) = ν(H2SO4) = 0,408 · 6,02·1023 = 2,456·1023 молекул.
Ответ: ν(H2SO4) = 0,408 моль. N (H2SO4) = 2,456·1023 молекул H2SO4.
 Пример 2. Рассчитать количество вещества и объём аммиака, содержащего 1,204·1024 молекул.
Пример 2. Рассчитать количество вещества и объём аммиака, содержащего 1,204·1024 молекул.

Дано: Решение:
N(NH3) =1,204·1024М(NH3) – 14 + 1· 3 = 17 г/моль.
______________ 1. 1 моль вещества содержит 6,02·1023 молекул 
ν(NH3) =? ν моль содержит 1,204·1024молекул:
V(NH3) =? 
 .
.
2. 1 моль газа занимает объём Vm = 22,4 л при н.у.
Объём 2 моль газа V(NH3):
V (NH3) = Vm · ν(NH3) = 22,4 л/моль · 2 моль = 44,8 л.
Ответ: ν(NH3) = 2 моль. V (NH3) = 44,8 л.
Пример 3. Вычислить а) эквивалентную массу серной кислоты;
б) эквивалентную массу серной кислоты в реакции:
H2SO4 + NaOH → NaHSO4 + H2O.
Решение: а) Эквивалентная масса кислоты:

б) Эквивалентная масса серной кислоты в реакции рассчитывается с учетом атомов водорода (n) в молекуле кислоты, замещенных на атомы металла. В данной реакции n = 1, таким образом:
 .
.
Пример 4. Оксид 2-х валентного металла содержит 71,43% металла. Определить металл и его эквивалентную массу.
 Дано: Решение:
Дано: Решение:
МеО 1.Для простоты возьмем массу оксида равной 100 г. Тогда масса
ω(Ме) = 71,43% металла составит 71,43 г, а масса кислорода:
Ме(II) -?  = 100 - 71,43 = 28,57 г.
= 100 - 71,43 = 28,57 г.
Э(Ме) =? 2. Найдем эквивалентную массу кислорода в оксиде
по формуле (1.2.):
 .
.
3. По закону эквивалентов (1.7.) определим эквивалентную мас-
су металла:


4. Найти атомную массу металла и определить металл:
А(Ме)= Э(Ме) · с.о. = 20 · 2 = 40 г/моль.
По данным таблицы Д.И.Менделеева определяем, что такую атомную массу имеет металл кальций.
Ответ: металл – кальций.
Пример 5. Вывести формулу оксида хрома, зная, что содержание хрома в этом веществе составляет 68,4%.
 Дано: Решение:
Дано: Решение:
ω(Cr) = 68,4% 1. Определим процентное содержание кислорода в оксиде:
__________ ω(О) = 100% - ω(Cr) = 31,6%.
CrxOy 2. Атомные массы храма и кислорода, соответственно равны:
А(Cr) = 52 а.е.м. и А(О) = 16 а.е.м.
3. По формуле (1.1.) определяем количественное соотношение
атомов хрома и кислорода в молекуле оксида:
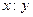

Соотношение x: y должно быть в виде целых чисел, поэтому
сначала оба члена делим на наименьшее из них:
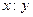 =
=  .
.
Умножив, оба члена на 2, получаем:
x: y = 2: 3.
Таким образом, формула оксида хрома: Cr2O3
Ответ: Cr2O3 – оксид хрома (III).
Не нашли, что искали? Воспользуйтесь поиском: