
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Глава 3. Вычисление водородного показателя
При решении задач, в которых нужно рассчитать рН или, наоборот, по известному значению рН определить концентрацию раствора, необходимо учитывать несколько моментов:
1. Написать уравнение диссоциации кислоты (основания), рН которого
требуется рассчитать.
2. При вычислении рН раствора основания по известному значению его
концентрациидля определения концентрации Н+ используют ионное произведение воды (7.12.).
3. Электролиты слабые и средней силы диссоциируют ступенчато (7.4.),
поэтому при вычислении рН такого раствора концентрацию рН-определяющего иона определяют по I ступени диссоциации.
4. Для упомянутых выше электролитов обязательно необходимо учитывать значение степени электролитической диссоциации.
5. Концентрация водородных ионов при вычислении рН должна быть выражена в единицах моль/л, поэтому всегда концентрация раствора, рН которого вычисляется, должна быть переведена в молярную.
Пример 12. Рассчитать концентрацию водородных и гидроксильных ионов. Указать реакцию среды раствора, рН которого равен 9. Рассчитать массу гидроксида калия в 1 литре такого раствора.
 Дано: Решение:
Дано: Решение:
рН = 9 1. Согласно уравнению (7.14.), рН = 9 соответствует концентра-
__________ ции ионов Н+:
[H+] =? [H+] = 10-рН = 10-9 моль/л.
[OH-] =? 2. Через ионное произведение воды (7.12.) найдем значение [OH-]:
m(КОН) =? 
3. Найденное значение рН соответствует щелочной среде,
поэтому составим уравнение диссоциации щелочи:
КОН ↔ К+ + ОН-.
Из уравнения очевидно, что 1 моль КОН дает 1 моль ОН-,
следовательно, при найденной [OH-] = 10-5 концентрация
раствора однокислотного основания КОН:

4. Сделаем расчёт массы КОН, предварительно вычислив
молярную массу этого вещества:

далее по формуле (7.4.) рассчитываем m(KOH):
 Ответ: [H+] = 10-9 моль/л; [OH-] = 10-5 моль/л;
Ответ: [H+] = 10-9 моль/л; [OH-] = 10-5 моль/л;
m(KOH) = = 5,6·10-6 г.
Пример 13. Рассчитать рН 0,5 М растворов: а) H2SO4; б) КОН.
Дано: Решение:
См(H2SO4) = 0,5 М 1. Составим уравнение диссоциации серной кислоты,
См(КОН) = 0,5 М которая, являясь сильным электролитом, диссоциирует в
______________ одну стадию:
рН(H2SO4) =? H2SO4 ↔ 2H+ + SO42-.
рН(КОН) =? 2. На основании полученного уравнения рассчитываем
концентрацию ионов Н+:
1 моль H2SO4 даёт 2 моль H+, следовательно:
0,5 моль/л H2SO4 соответствует [H+] =?

3. По формуле (7.13) находим рН 0,5 М раствора H2SO4:

4. Аналогично составляем уравнение диссоциации КОН:
КОН ↔ К+ + ОН-,
из которого можно сделать вывод:
1 моль КОН дает 1 моль ОН-, следовательно:
0,5 моль/л КОН соответствует [ОН-] = 0,5 моль/л.
5. Через ионное уравнение воды (7.12.) по найденной [OH-]
 рассчитаем [H+]:
рассчитаем [H+]:
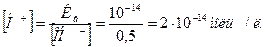
6. По формуле (7.13) находим рН 0,5 М раствора КОН:

Пример 14. Рассчитать рН 15%-ной сернистой кислоты, степень электролитической диссоциации которой 20%.
Дано: Решение:
H2SO3 1. Составим уравнение диссоциации сернистой кислоты,
ω = 15% которая, являясь электролитом средней силы, диссоциирует
α = 20% на ионы ступенчато. В соответствии с изложенным выше
____________ (п.3), для расчета рН такой кислоты потребуется знание
рН =? [H+] на I стадии диссоциации двухосновной кислоты:
H2SO3 ↔ H+ + НSO3-,
т.е. 1 моль кислоты соответствует 1 моль Н+.
2. Согласно требованию п. 5 (см. выше), рассчитаем молярную
концентрацию 15%-ного раствора этой кислоты, принимая
плотность раствора ρ = 1 г/мл:
а) Молярная масса H2SO3: М(H2SO3) = 82 г/моль.
б) 15%-ный раствор кислоты при ρ = 1 г/мл: в 100 мл
содержится 15 г чистого вещества, таким образом:

3. В соответствии с п.3, концентрация ионов Н+ не может
 быть равна См(H2SO3), при расчёте [H+] надо учитывать α:
быть равна См(H2SO3), при расчёте [H+] надо учитывать α:

4. По формуле (7.13.) рассчитаем рН:

Ответ: рН = 0,4366.
Раздел 3. КОНТРОЛЬНЫЕ ЗАДАНИЯ
Не нашли, что искали? Воспользуйтесь поиском: