
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Растворы молярной и нормальной концентрации
При решении таких задач обязательно необходимо знать химическую формулу вещества, т.к. для расчёта молярной концентрации нужно знать молярную массу вещества (формула 7.4.), а для нормальной концентрации – эквивалентную массу (формула 7.5.).
Пример 5. Рассчитать молярность (См) и нормальность (Сн) раствора, в 250 мл которого содержится 2,5 г карбоната натрия.
Дано: Решение:
Na2CO3 1. Рассчитаем молярную и эквивалентную массы Na2CO3:
m(Na2CO3) = 2,5 г М(Na2CO3) = 23 · 2 + 12 + 16 · 3 = 106 г/моль.
 Vр-ра = 250 мл
Vр-ра = 250 мл 
_____________ 2. По формуле (7.4.) найдем молярную концентрацию:
См =? 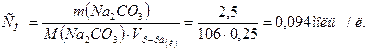
Сн =? 3. По формуле (7.5.) найдем нормальную концентрацию:

Ответ: См = 0,094 М. Сн = 0,188 н.
Пример 6. Сколько грамм кристаллогидрата CuSO4·5H2O нужно взять для приготовления 200 мл 0,25 н. раствора?
 Дано: Решение:
Дано: Решение:
CuSO4·5H2O 1. Рассчитаем М(CuSO4·5H2O), необходимую для расчёта
V = 200 мл эквивалентной массы. Последнюю рассчитываем по форму-
Сн = 0,25 н. ле (1.5.), принимая ∑с.о. = 2:
М(CuSO4·5H2O)= 250 г/моль.
m(CuSO4·5H2O) =?

2. Преобразуя формулу (7.5), находим m(CuSO4·5H2O):

Ответ: m(CuSO4·5H2O) = 6,25 г.
Пример 7. Какой объём 20%-ной соляной кислоты потребуется для приготовления 250 мл 0,1н. раствора?
Дано: Решение:
 HCl 1. При занесении данных условия задачи нижним индексом «1»
HCl 1. При занесении данных условия задачи нижним индексом «1»
 ω1 = 20% записываем параметры исходного раствора, индексом «2» -
ω1 = 20% записываем параметры исходного раствора, индексом «2» -
ρ1 = 1,098 г/мл приготавливаемого раствора.
V2 = 250 мл 2. Рассчитаем молярную массу вещества, которая в случае од-
Сн(2) = 0,1 н. ноосновной соляной кислоты равна её эквивалентной массе:
___________ M(HCl) = Э(HCl) = 36,5 г/моль.
V1 =? 3. Преобразуя формулу (7.5), находим m(HCl) – массу чистого
вещества, которая должна содержаться в полученном раст-
воре:

4. Преобразуя формулу (7.1), находим массу исходного раство-
ра, который должен содержать 0,9125 г чистого вещества HCl:

5. Используя значение плотности 20%-ного раствора соляной
кислоты, рассчитаем требуемый объём исходного раствора:

Ответ: V1 = 4,15 мл.
Пример 8. Рассчитать титр и нормальность раствора щавелевой кислоты, в 200 мл которого содержится 0,32 г Н2С2О4·Н2О.
Дано: Решение:
 Н2С2О4·Н2О 1. Титр раствора – один из способов выражения концент-
Н2С2О4·Н2О 1. Титр раствора – один из способов выражения концент-
V = 200 мл рации, значение которой, рассчитанное по формуле
m(Н2С2О4·Н2О) = 0,32 г (7.6.), показывает количество грамм растворенного ________________ вещества содержащееся в 1 мл раствора. Значение этой
Тр-ра(Н2С2О4·Н2О) =? величины должно быть рассчитано с точность до чет-
Cн(Н2С2О4·Н2О) =? вертой значащей цифры после последнего нуля:
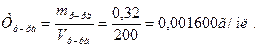
2. Для определения нормальности раствора необходимо
рассчитать Э(Н2С2О4·Н2О), учитывая, что это двухосновная
кислота:

3. Преобразуя формулу (7.7), находим нормальность:

Или то же самое по формуле (7.5.):
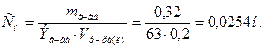
Ответ: Тр-ра(Н2С2О4·Н2О) = 0,001600 г/мл.
Cн(Н2С2О4·Н2О) = 0,0254 н.
Глава 2. Вычисления в титриметрическом (объёмном) анализе
В основе этих вычислений, как и в основе самого метода титриметрического анализа, лежит закон эквивалентов: вещества реагируют друг с другом в эквивалентных количествах (глава 1, раздела 1). На титрование до точки эквивалентности всегда расходуется одинаковое число эквивалентных масс реагирующих веществ, которые взяты не в чистом виде, а в виде растворов. Для проведения титрования наиболее удобно использование растворов нормальной концентрации.
Результаты анализа вычисляются различными способами.
2.1. Вычисление по правилу пропорциональности
В приложении к реакциям, протекающим в растворах, закон эквивалентов выражается правилом пропорциональности:
 Растворы с разной нормальной концентрацией реагируют объёмами обратно пропорциональными их нормальным концентрациям
Растворы с разной нормальной концентрацией реагируют объёмами обратно пропорциональными их нормальным концентрациям
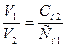 или
или  . (10.1)
. (10.1)
Пример 9. Вычислить массу КОН, содержащегося в 250 мл раствора, если на титрование 10 мл этого раствора расходуется 8,5 мл 0,0952 н.HCl.
 Дано: Решение:
Дано: Решение:
Vобщ (КОН) = 250 мл 1. Преобразуя формулу (10.1), рассчитаем нормальность
Vа.р.(КОН) = 10 мл раствора КОН:
Сн(HCl) = 0,0952 н. 
Vт(HCl) = 8,5 мл 2. Зная Сн(КОН) и преобразуя формулу (7.5.), находим:
m(КОН) =?

Ответ: m(КОН) = 1,1326 г.
Не нашли, что искали? Воспользуйтесь поиском: