
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Вычисления через поправочный коэффициент
При обработке результатов титриметрического анализа используют поправку, называемую поправочным коэффициентом.
 Поправочный коэффициент (поправка – К ) - это отношение практической концентрации раствора к теоретической:
Поправочный коэффициент (поправка – К ) - это отношение практической концентрации раствора к теоретической:
 или
или  (10.3)
(10.3)
Поправочный коэффициент необходим для определения точной концентрации растворов нестандартных веществ, содержащих примеси, и неустойчивых при хранении. Поскольку, согласно правилу пропорциональности (10.1), объёмы растворов реагирующих веществ обратно пропорциональны их нормальным концентрациям, то:
 (10.4.)
(10.4.)
Пример 11. Вычислить нормальную концентрацию соляной кислоты, если на титрование 10 мл её раствора расходуется 8,9 мл раствора буры Na2B4O7·10H2O, приготовленного растворением 2г соли в мерной колбе на 100 мл.

 Дано: Решение:
Дано: Решение:
V (HCl) = 10 мл 1. Рассчитаем эквивалентную массу Na2B4O7·10H2O:
V(Na2B4O7) = 8,9 мл 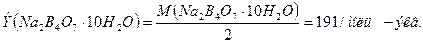
m(Na2B4O7·10H2O) = 2 г 2. Найдем по формуле (7.5.) нормальную концентрацию
Vобщ = 100 мл этого раствора:
Сн(HCl) =?

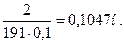
3. Поправочный коэффициент раствора Na2B4O7:

4. По правилу пропорциональности определим К(HCl):

5. Находим концентрацию Сн(HCl):

Ответ: Сн(HCl) = 0,0932 н.
Не нашли, что искали? Воспользуйтесь поиском: