
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
ГЛАВА 1. ФУНКЦИОНАЛИЗАЦИЯ ФЕНИЛЕНОВЫХ ЦИКЛОТРИМЕРОВ И ПОЛИФЕНИЛЕНОВ ЛИГАНДАМИ КАРБЕНОВОГО ТИПА НА ОСНОВЕ N-МЕТИЛИМИДАЗОЛА.
1.1. СИНТЕЗ МОНО- И ДИАЦЕТИЛАРОМАТИЧЕСКИХ СОЕДИНЕНИЙ В КАЧЕСТВЕ МОНОМЕРОВ ДЛЯ ЦИКЛО- И ПОЛИЦИКЛОКОНДЕНСАЦИИ.
Синтезу полимеров и иммобилизации карбеновых лигандов на полимеры, предшествовала разработка препаративных методов получения мономеров.
В настоящей работе для иммобилизации каталитических групп в качестве полимерных матриц были выбраны полифенилены (ПФ), получаемые полициклоконденсацией (ПЦК) ацетилароматических соединений. Ниже описан синтез соответствующих мономеров – моно- и диацетилароматических соединений.
Предполагалось, что группы N-гетероциклического карбенового лиганда на основе N-метилимидазола должны быть введены в полимер через монофункциональный ацетильный мономер, где изначально в п -положении к ацетильной группе находилась бы группа галогеналкила.
Схема 34.

4'-Бромметилацетофенон (мономер 1) получали в две стадии из толуола (схема 34). Первоначально по реакции Фриделя-Крафтса ацилировали толуол. Затем по модифицированной методике [180] образовавшийся 4'-метилацетофенон радикально бромировали, используя 1,3-дибром-5,5-диметилгидантоин, и с выходом 83% получали 4'-бромметилацетофенон (1).
4'-(β-Хлорэтил)-ацетофенон (мономер 2) синтезировали из фенетола путём замещения гидроксогруппы на галоген и последующим ацилированием полученного фенетилхлорида с выходом целевого продукта 74% (схема 35).
Схема 35.

Мономер 3 ( 4'-(6''-бромгексил)-ацетофенон) был получен ацилированием 6'-бромгексилбензола, который в свою очередь был синтезирован алкилированием бромбензола с выходом 62% (схема 36).
Схема 36.

Синтез диацетилароматических соединений проводили путём диацилирования по реакции Фриделя-Крафтса соответствующих ароматических соединений – дифенила и дифенилоксида (схема 37 и 38) по ранее описанной методике [182].
Схема 37.

Подтверждение строения полученных мономеров проводили основными физико-химическими методами анализа (табл. 8).
Схема 38.

Таблица 8.
Свойства моно- и дифункциональных мономеров.
| № соед. | Тпл./кип., оС | MS: m/z | ЯМР | Элементный анализ, % |
| 36-38 | 1H ЯМР: 2.57 (с, 3H, CH3), 4.48 (с, 2H, CH2), 7.46 (д, J = 8 Гц, 2H, аром.), 7.90 (д, J = 8 Гц, 2H, аром.). 13C ЯМР: 26.8, 32.2, 128.9, 129.3, 136.9, 142.8, 197.4. | Найдено, %: Br – 37,38. Вычислено, %: Br – 37,50. | ||
| 121-122 /2 мм рт. ст. | 1H ЯМР: 2.49 (с, 3H, CH3), 3.01-3.05 (т, J = 8.4 Гц, 2H, CH2), 3.64-3.68 (т, J = 8.4 Гц, 2H, CH2), 7.23 (д, J = 8.4 Гц, 2H, аром.), 7.82 (д, J = 8.4 Гц, 2H, аром.). 13C ЯМР: 26.6, 38.8, 44.4, 128.6, 129.1, 135.8, 143.5, 197.6. | Найдено, %: Cl – 19,43. Вычислено, %: Cl – 19,41. | ||
| 112/2 мм рт. ст. | 1H ЯМР: 1.26-1.31 (м, J = 7.2 Гц, 4H, СН2), 1.54-1.59 (м, J = 7.2 Гц, 4H, СН2), 2.48 (с, 3H, CH3), 2.53-2.56 (м, J = 7.8 Гц, 4H, CH2), 7.21 (д, J = 8.4 Гц, 2H, аром.), 7.78 (д, J = 8.4 Гц, 2H, аром.). 13C ЯМР: 28.0, 28.2, 29.3, 31.2, 32.6, 33.7, 36.0, 128.0, 128.6, 133.9, 143.0, 199.8. | Найдено, %: Br – 28,13. Вычислено, %: Br – 28,21. | ||
| 193-195 | 1H ЯМР: 2.67 (c, 6H, CH3), 7.67 (д, J = 8.4 Гц, 4H, аром.), 8.02 (д, J = 8.4 Гц, 4H, аром.). 13C ЯМР: 28.9, 127.6, 129.1, 135.4, 140.5, 199.7. | Найдено, %: C – 80,60, H – 5,82, O – 13,58. Вычислено, %: C – 80,65, H – 5,92, O – 13,43. | ||
| 99-101 | 1H ЯМР: 2.60 (c, 6H, CH3), 7.08 (д, J = 8.4 Гц, 4H, аром.), 7.98 (д, J = 8.4 Гц, 4H, аром.). 13C ЯМР: 29.0, 117.2, 128.4, 129.6, 161.2, 199.3. | Найдено, %: C – 75,38, H – 5,43, O – 19,19. Вычислено, %: C – 75,57, H – 5,55, O – 18,88. |
Таким образом, на первом этапе работы была синтезирована и охарактеризована серия моно- и дифункциональных мономеров (1-3, 5, 6), комбинацией которых в реакции ПЦК был впоследствии получен ряд нерастворимых ПФ с различной длиной алифатической цепи и, как следствие, различной подвижностью лигандов, что влияет [137] на процесс комплексообразования в матрице полимера.
1.2. СИНТЕЗ АРОМАТИЧЕСКИХ ЦИКЛОТРИМЕРОВ И ИХ ФУНКЦИОНАЛИЗАЦИЯ.
Синтез и исследование свойств функционализированных циклотримеров на основе 1,3,5-трифенилбензола, являющихся модельными соединениями по отношению к ПФ, позволяют прогнозировать строение и характеристики нерастворимых ПФ. Циклоконденсация моноацетилароматических соединений – наиболее простой и надежный способ синтеза разветвленных молекул [51]. В результате этой реакции генерируется новое 1,3,5–трифенилзамещенное бензольное ядро. Фениленовые циклотримеры (7 – 8) с различной длиной алифатической цепи были получены тримеризацией (схема 39) соответствующих моноацетилароматических соединений в присутствии триэтилортоформиата в бензоле при пропускании сухого хлороводорода.
Схема 39.

Свойства полученных соединений приведены в таблице 9. К тому же соединения 7 и 8 были охарактеризованы методом РСА (рис. 1 и 2 соответственно).
Таблица 9.
Свойства циклотримеров 7 – 8.
| Тпл, оС | MS: m/z | Элементный анализ, найдено/вычислено, % | ||||
| С | Н | Br | Cl | ||||
| R– | 7 
| 191-193 [175] | 55,5 55,4 | 3,7 3,6 | 40,8 41,0 | – | |
8 
| 68-69 | 73,1 73,0 | 5,3 5,5 | – | 21,6 21,5 |
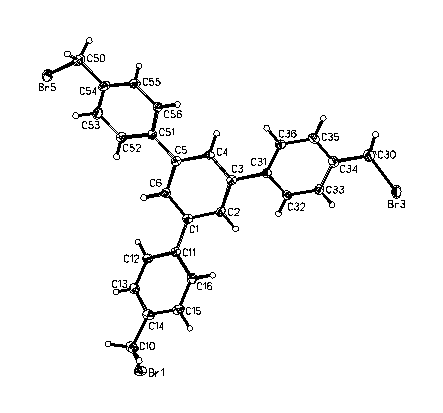
Рис.1. РСА соединения 7.

Рис.2. РСА соединения 8.
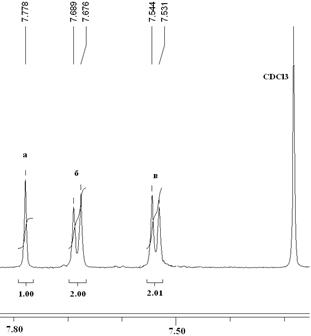
В 1H ЯМР-спектрах соединений 7 (рис. 3)и 8 (рис. 4) можно четко отнести сигналы протонов центрального бензольного кольца - синглеты при 7.74 (8) и 7.78 (7) м.д. (протоны а), а также сигналы, характеризующие внешние бензольные кольца: дублет при 7.62 м.д., J = 8 Гц (8) и 7.67 м.д., J = 7.8 Гц (7) (о –положение, протоны б), дублет при 7.31 м.д., J = 8 Гц (8) и 7.53 м.д., J = 7.8 Гц (7) (м –положение, протоны в). В спектрах имеются сигналы, характерные для протонов алифатических заместителей: синглет при 4.59 м.д. относится к протонам CH2-группы соединения 7, триплеты при 3.10-3.14 м.д., J = 7.6 Гц (протоны г) и 3.74-3.78 м.д., J = 7.6 Гц (протоны д) относятся к протонам двух метиленовых групп соединения 8.
Отнесение сигналов в 13С ЯМР-спектре соединения 7 проводилось с помощью методики J-модулируемого эха (рис. 5). Сигнал при 125.2 м.д. относится к третичным атомам углерода центрального бензольного кольца (а). Сигналы при 141.7 м.д. (б) и 141.0 (е), 137.2 м.д. (в) относятся к четвертичным атомам углерода соответственно центрального и периферийного бензольных колец. Незамещенные атомы углерода внешнего бензольного кольца характеризуется сигналами при 129.6 м.д. (м–положение, д) и 127.7 м.д. (о–положение бензольного кольца, г). Алифатические атомы углерода характеризуются сигналом при 33.3 (ж) м.д.
| 
|
Рис. 3. 1H ЯМР-спектр циклотримера 7.
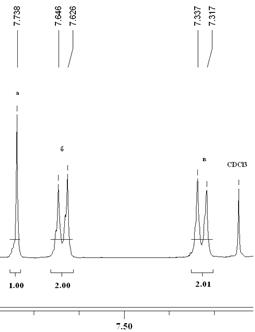 
|
Рис. 4. 1H ЯМР-спектр циклотримера 8.
В 13С ЯМР-спектре соединения 8 (рис. 6) сигнал при 124.9 м.д. относится к третичным атомам углерода центрального бензольного кольца (а). Сигналы при 139.7 м.д. (б) и 137.5 (в), 141.9 м.д. (е) относятся к четвертичным атомам углерода соответственно центрального и периферийного бензольных колец. Незамещенные атомы углерода внешнего бензольного кольца характеризуется сигналами при 129.4 м.д. (м –положение, д) и 127.5 м.д. (о –положение бензольного кольца, г). Алифатические атомы углерода характеризуются сигналами при 38.6 (з) и при 44.9 (ж) м.д.

| 
|
Рис. 5. 13С ЯМР-спектр циклотримера 7.

|
 
|
Рис. 6. 13С ЯМР-спектр циклотримера 8.
На основе циклотримеров 7 и 8 были синтезированы соответствующие соли N-метилимидазола (соединения 9 и 10), которые являются предшественниками N-гетероциклических карбеновых лигандов. Выбор N-метилимидазола обусловлен его доступностью и возможностями модификации. К тому же производные N-метилимидазола хорошо себя зарекомендовали в качестве предшественников N-гетероциклических карбеновых лигандов, поскольку синтез их солей и карбеновых комплексов палладия на их основе прост методически и в большинстве случаев не вызывает особых затруднений.
Таким образом, по реакции фениленовых циклотримеров 7 и 8 с тремя эквивалентами N-метилимидазола в растворе ДМФА получили соответствующие имидазолиевые соли (схема 40).
Схема 40.

Циклотримеры 9 и 10 были охарактеризованы с помощью основных методов физико-химического анализа (рис. 7, 8, 9; табл. 10).
В 1Н ЯМР-спектре соединения 9 (рис. 7) можно отнести сигналы протонов центрального бензольного кольца и сигналы протонов о -положения периферийных бензольных ядер (мультиплет при 7.90-7.95 м.д., J = 7.2 Гц, протоны а и б) и сигналы, относящиеся к протонам м -положения внешних бензольных колец (триплет при 7.57-7.59 м.д., J = 7.2 Гц, протоны в). Имидазольный фрагмент характеризуется тремя сигналами: синглеты при 7.74 и 7.85 м.д. относятся к протонам ж и е соответственно, дублет при 9.29 м.д., J = 9.6 Гц характеризует фрагмент N-C H- N, протоны д. В алифатической части спектра также содержатся два сигнала, относящиеся к метиленовой (5.50 м.д., протоны г) и метильной (3.88 м.д., протоны з) группам. Спектр соединения 10 практически идентичен спектру соединения 9 за исключением алифатической части, где наблюдается три сигнала, вместо двух за счет увеличения длины алифатической углеродной цепи на одну метиленовую группу.
В 13С ЯМР-спектре соединения 9 отнесение сигналов проводилось с помощью методики J-модулируемого эха (рис. 8). Сигналы при 141.4 м.д. (б) и 140.7 (е), 134.9 м.д. (в) относятся к четвертичным атомам углерода центрального и периферийного бензольных колец соответственно. Сигнал при 125.2 м.д. относится к третичным атомам углерода центрального бензольного кольца (а). Незамещенные атомы углерода внешнего бензольного кольца характеризуется сигналами при 129.5 м.д. (м –положение, д) и 128.2 м.д. (о –положение бензольного кольца, г). Сигналы при 122.8 (з), 124.5 (и) и 130.4 (к) принадлежат атомам углерода имидазольного фрагмента. Алифатические атомы углерода характеризуются сигналами при 36.4 (л) и при 51.9 (ж) м.д.
Данные элементного и масс-спектрометрического анализов соединений 9 и 10 приведены в таблице 10.
Таблица 10.
Свойства соединений 9 и 10.
| № соед. | Тпл., оС | MS: m/z | Элементный анализ, % |
| 232-236 | Найдено, %: C – 47,52, H – 4,21, I – 39,43, N – 8,84. Вычислено, %: C – 48,17, H – 4,04, I – 39,15, N – 8,64. | ||
| 202-205 | Найдено, %: C – 49,90, H – 4,91, I – 37,16, N – 8,03. Вычислено, %: C – 49,72, H – 4,47, I – 37,52, N – 8,28. |
В ИК-спектре соединения 9 (рис. 9) кроме характерных для данного типа соединений колебаний (ароматических при 700-780, 880, 1 600 см–1) и алифатических (1510 и 2850-2970 см-1) появляются полосы, характеризующие колебания связей N-H имидазольного фрагмента при 3420 см-1.





Рис. 7. 1Н ЯМР-спектр соединения 9.

Рис. 9. ИК-спектр соединения 9.
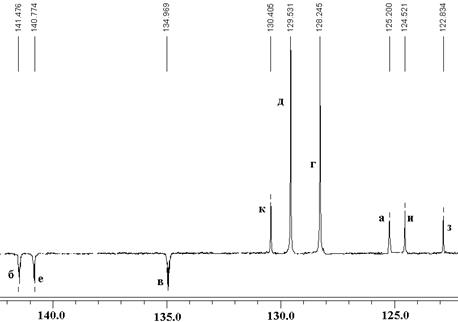

Рис. 8. 13С ЯМР-спектр соединения 9.
Таким образом, на данном этапе работы на основе полученных моноацетилароматических мономеров были синтезированы и всесторонне охарактеризованы фениленовые циклотримеры (7 и 8) и соли N-метилимидазолия на их основе (9 и 10), используемые в качестве модельных соединений по отношению к синтезированным в дальнейшем функционализированным ПФ (ПФИ).
1.3. СИНТЕЗ ПОЛИФЕНИЛЕНОВ И ИМИДАЗОЛИЕВЫХ СОЛЕЙ НА ИХ ОСНОВЕ.
Полифенилены (ПФ) синтезировали с использованием реакции циклоконденсации моно- и диацетилароматических соединений. При этом все полимерообразующие реакции проводили до стадии гелеобразования с целью получения нерастворимых полимеров в одну стадию. В общем виде реакция изображена на схеме 41, где не учитывается образование дефектных β-метилхалконовых, поливиниленовых и других фрагментов [51]. Реакцию проводили при соотношении моно- (1, 2, 3) и диацетилароматических (4, 5, 6) мономеров 1 / 1,2 с добавлением 1,3 моль триэтилортоформиата в бензоле при пропускании сухого хлороводорода. Незначительный избыток дифункционального мономера приводит к разветвлению полимерной цепи и, как следствие, нерастворимости синтезируемого полимера. После образования геля реакционную массу высаждали в метанол, выпавший осадок отфильтровывали и для удаления низкомолекулярных растворимых фракций экстрагировали хлороформом в аппарате Сокслета, поскольку ПФ, синтезируемые методом ПЦК полидисперсны.Таким путем была получена серия нерастворимых ПФ (табл. 11) с галогеналкильными группами (бромметильной, хлорэтильной и бромгексильной).
Схема 41.
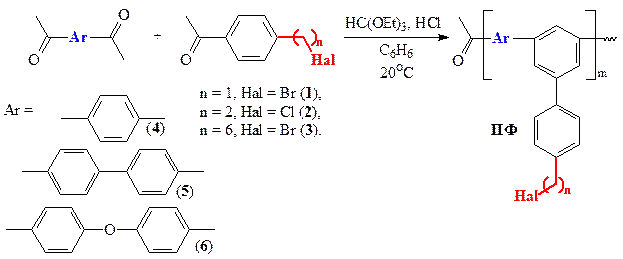
Ввиду того, что полученные ПФ нерастворимы, доказательства их строения проводились при помощи методов ИК-спектроскопии и элементного анализа (см. эксперим. часть) и сравнения этих данных с данными по растворимым ПФ, полученным аналогичным способом и ранее хорошо изученным [51].

| 
| 
| |

| 
| 
| 
|

| 
| 
| 
|

| 
| 
| 
|
Таблица 11. Серия нерастворимых полифениленов.
Образование ПФ было подтверждено появлением в ИК-спектрах полосы в области 880 см-1, характерной для внеплоскостных деформационных колебаний изолированного атома водорода 1,3,5-замещённого бензольного кольца. Наличие в полимерах концевых кетальных и ацетильных групп подтверждают полосы в области 1680 и 1270 см-1, характерные для валентных колебаний C=O-группы ароматических кетонов, и полосы в области 1060, 1100-1300 и 1150-1175 см-1, характерные для алифатической С-O-связи. В качестве примера на рис. 10 приведён ИК-спектр ПФ на основе 4,4'-диацетилбензола (5) и 4'-бромметил-ацетофенона (1) (ПФ-1-5) в сравнении с его имидазолиевой солью ПФИ-1-5 (рис. 11). Полоса 880 см-1 относится к 1,3,5-замещённому бензольному кольцу, а полосы 700 и 760 см-1 характерны для фенильного и п -фениленового заместителя соответственно. Интенсивные полосы 1050 и 1180 см-1 характеризуют, как указано выше, концевые группы. К концевым группам относятся суммарная полоса поглощения деформационных колебаний С-Н-связей метильной и метиленовых групп в области 1490 см-1 и полосы небольшой интенсивности в области 2920-2950 см-1 валентных С-Н-колебаний. Следует считать, что пик 1650 см-1 характеризует наличие в полимере карбонильной группы дипнонового (β-метилхалконового) фрагмента, если учесть, что в области 1215 см-1 также имеется полоса, соответствующая данной группе. Интенсивные полосы 1500, 1600 см-1 относятся к колебаниям С=С и С-Н-связей бензольного кольца. Полоса в области 600 см-1 относится к валентным колебаниям связи C-Br.
Элементный анализ (см. экспериментальную часть) полученных ПФ даёт лишь относительные результаты, поскольку неизвестно точное строение полимерной цепи, концевых групп и количество дефектных структур. Однако, экспериментальные данные на содержание галогена в полимере в дальнейшем использовались для расчёта загрузки N-метилимидазола при синтезе его солей.

Рис. 10. ИК-спектр ПФ-1-5.

Рис. 11. ИК-спектр соединения ПФИ-1-5.
На основе синтезированных ПФ получали соли имидазола (ПФИ) по реакции ПФ с 1,1 эквивалентом N-метилимидазола в растворе ДМФА в присутствии йодида натрия. Последний вводится в реакцию ввиду того, что соли имидазола с йодид-анионом обладают большей растворимостью в органических растворителях, нежели содержащие бромид- и тем более хлорид-анионы. Необходимо также отметить, что объём растворителя не должен быть меньше величины набухаемости полимеров, чтобы во время синтеза полимер находился в максимально набухшем состоянии (схема 42).
Схема 42.

После функционализации ПФ строение полимеров (ПФИ) идентифицировалось методами ИК-спектроскопии и элементного анализа (см. эксперим. часть).
В ИК–спектрах ПФИ (рис. 11), как и в исходных полимерах, содержатся интенсивные полосы при 1 590 см–1 и 880 см–1, что характеризует колебания связей ароматического кольца, полоса при 880 см–1 относится к 1,3,5–тризамещенному бензольному кольцу. Полосы в области 2800-3050 см-1 принадлежат алифатическим участкам макромолекул. При этом появляются полосы при 3420 см-1, относящиеся к колебаниям связей N-H имидазольных фрагментов.
Таким образом, сопоставление ИК-спектров ПФ со спектрами их производных - имидазолиевых солей (ПФИ), свидетельствует об образовании соли N-метилимидазолия на полифениленовых матрицах (схема 42).
Согласно литературным данным из всех карбеновых комплексов наиболее просто получить комплексы состава (N-гетероциклический карбен)2PdX2 [85, 86]. В этой связи было решено синтезировать полимер, содержащий два лигандообразующих фрагмента в одном мономерном звене, что в свою очередь должно приводить при получении комплекса к его формированию структурными элементами одного звена. Таким образом, были синтезированы сшитые полимеры за счет взаимодействия циклотримеров, содержащих галогеналкильные группы, с дифункциональным кросс-агентом на основе имидазола, где две имидазольные группы соединены между собой алифатическим спейсером, что обеспечивает гибкость комплексообразующим фрагментам и, как следствие, вероятность образования комплекса возрастает.
Для этого по реакции имидазола с 1,2-дибромэтаном в присутствии основания был получен кросс-агент – 1,2-ди-N,N'-имидазолилэтан (11) (схема 43).
Схема 43.

Строение соединения 11 было подтверждено при помощи основных методов физико-химического анализа (см. экспериментальную часть).
Взаимодействие кросс-агента 11 с циклотримерами 7, 8 приводит к сшитым полимерам ТП-1 и ТП-2 соответственно (схема 44), которые выпадают из раствора в процессе синтеза, поскольку нерастворимы за счёт высокой молекулярной массы.
Схема 44.

Важным показателем полимеров, особенно при их использовании в реакциях гетерогенного катализа в качестве матриц, является их набухаемость. Для серии полученных полимеров было проведено исследование набухаемости. Поглощение растворителей полимерами определялось в статических условиях. Исследуемый образец выдерживался в растворителе до достижения равновесной набухаемости, затем после удаления растворителя измерялся вес полимера. После сушки полимер повторно взвешивался. По разности масс влажного и сухого образцов определялась величина набухаемости. Примечательно отметить, что по набухаемости ПФ, синтезированные методом ПЦК, несильно отличаются друг от друга. При этом максимальной величины набухаемости достигают полимеры синтезированные на основе 4,4'-диацетилдифенила (мономер 5). Это объясняется жесткой структурой полимера в совокупности с максимальным межузловым расстоянием в звеньях полимерной цепи в сравнении с другими ПФ этой серии. Полимеры ТП-1 и ТП-2 набухают на порядок сильнее (табл. 12). Данное различие обусловлено тем, что в случае полимеров ТП-1 и ТП-2 формирование макромолекулярной цепи идёт в трёх направлениях и образуется сшитый полимер, в то время как структура ПФ, полученные методом ПЦК незначительно разветвлённые за счет небольшого избытка дифункционального мономера.
Таблица 12.
Набухаемость полимеров, мл/г.
| Полимер | CHCl3 | С6H5-CH3 | MeOH | ДМФА | ТГФ |
| ПФИ-1-4 | 3,2 | 2,0 | 1,6 | 2,4 | 1,8 |
| ПФИ-1-5 | 3,9 | 4,1 | 2,4 | 5,3 | 3,5 |
| ПФИ-1-6 | 2,1 | 2,4 | 1,3 | 3,0 | 2,6 |
| ПФИ-2-4 | 3,4 | 4,0 | 3,4 | 4,3 | 4,5 |
| ПФИ-2-5 | 1,7 | 3,9 | 2,2 | 5,1 | 1,8 |
| ПФИ-2-6 | 1,4 | 0,9 | 1,0 | 2,4 | 1,6 |
| ПФИ-3-4 | 2,1 | 2,4 | 2,4 | 5,1 | 1,8 |
| ПФИ-3-5 | 2,0 | 1,2 | 2,3 | 2,1 | 1,6 |
| ПФИ-3-6 | 1,0 | 0,9 | 2,1 | 1,8 | 3,2 |
| TП-1 | 8,2 | 8,4 | 6,3 | 9,6 | 8,8 |
| TП-2 | 7,6 | 7,5 | 6,4 | 8,9 | 8,8 |
1.4. ПОЛУЧЕНИЕ КОМПЛЕКСОВ ПАЛЛАДИЯ.
N-гетероциклические карбеновые комплексы переходных металлов чаще всего синтезируются по реакции солей имидазола с солями переходных металлов в присутствии основания, давая комплекс состава (N-гетероциклический карбен)2PdX2 (где Х – кислотный остаток) [85, 86]. Для отработки методики синтеза комплексов палладия на ПФ и получения вещества сравнения было синтезировано и всесторонне проанализировано модельное соединение 13 на основе бензилхлорида и N-метилимидазола по схеме 45.
Схема 45.

Свойства полученного бис -(1-бензил-3-метилимидазолин-2-илиден) палладий (II) йодида (13) представлены в таблице 13.
Таблица 13.
Свойства модельного соединения 13.
| № соед. | Тпл., оС | MS: m/z | ЯМР | Элементный анализ, % |
| 164-165 | 1H ЯМР: 3.93 (с, 3H, NCH3), 4.07 (с, 3H, NCH3), 5.61 (с, 1H, NCH2), 5.73 (s, 1H, NCH2), 7.39-7.18 (м, 10H, аром.), 7.52 (с, 2H, HCCH), 7.64 (с, 2H, HCCH). 13C ЯМР: 37.2 (NCH3), 52.99 (NCH2), 121.2 (ArC), 123.4 (ArC), 127.9 (ArC), 128.0 (ArC), 128.5 (ArC), 128.6 (ArC), 128.7 (ArC), 137.4 (ArC), 169.3(NCN). | Найдено, %: C – 37,7; H – 3,4, N – 7,9, I – 36,2; Pd – 14,8. Вычислено, %: C – 37,5; H – 3,4, N – 8,0, I – 36,1 Pd – 15,1. |
Кроме этого соединение 13 было проанализировано методом рентгеновской фотоэлектронной спектроскопии (РФЭС) (рис.12). Данные по энергии связи для Pd в модельном соединении, полученные этим методом, использовались для сравнения с энергиями связи для Pd в полученных полимерах, чтобы иметь возможность судить об образовании комплексов на полимерных матрицах.

Рис. 12. Фотоэлектронный спектр Pd 3d комплекса 13.
Синтез N-гетероциклических палладиевых комплексов на основе полученных циклотримеров и полимеров проводили по модифицированной методике [188]. Поскольку синтезированные функционализированные полимеры (ПФИ) максимально набухают в ДМФА, то он и использовался в качестве растворителя для реакций циклотримеров и полимеров. В качестве основания применялся трет -бутилат калия, а источником палладия служил ацетат палладия.
Первоначально, чтобы оценить потенциальные каталитические возможности карбеновых лигандов, иммобилизованных на матрице ПФ, было решено синтезировать палладиевые комплексы на модельных циклотримерах 9 и 10 (схема 46) и протестировать их в ряде реакций кросс-сочетания.
При этом в процессе синтеза очевидно постепенное увеличение вязкости реакционного раствора. Это объясняется тем, за счет комплексообразования на трифункциональном мономере формируется полимер и с нарастанием молекулярной массы растворимость его падает, что в конечном итоге ведёт к тому, что полученный разветвлённый полимер выпадает из раствора, достигнув критических значений молекулярной массы.
Схема 46.
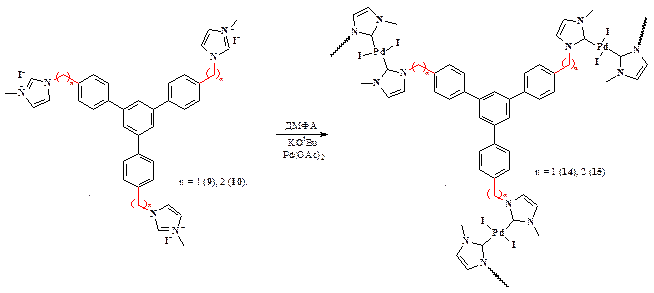
В последующих синтезах комплексов палладия на полимерах мы придерживались исключительно этой методики. При этом увеличили время реакции (схема 47, 48) по сравнению с гомогенными реакциями до 48 часов, поскольку реакции на полимерах протекают в гетерогенных условиях, когда полимер находится в набухшем состоянии, что создаёт некоторые трудности при образовании комплекса, по сравнению с условиями гомогенной реакции.
Схема 47.

В случае полимеров ТП-1, ТП-2 кроме внутримолекулярного (изображенного на схеме 48) возможно и межмолекулярное образование комплекса палладия. Доказательство точной структуры синтезированных комплексов затруднительно, хотя значения энергии связи Pd 3d5/2 соответствуют образованию комплекса (рис. 13).

Рис. 13. Фотоэлектронные спектры Pd 3d комплексов 14, Pd-ПФИ-2-5 и Pd-ТП-1.
Ввиду того, что синтезированные каталитические системы являются гетерогенными, доказательства образования комплексов палладия в полимерных матрицах весьма ограниченны по причине их нерастворимости. В нашей работе для решения этой проблемы мы использовали метод рентгеновской фотоэлектронной спектроскопии, который позволяет судить о состоянии палладия в соединениях. В данной части работы в сравнении с модельным соединением 13 приведены спектры комплексов на примере полимера 14, разветвлённого ПФ Pd-ПФИ-2-5 и сшитого ПФ Pd-ТП-1.
Схема 48.

В рентгеновских фотоэлектронных спектрах выделены два состояния Pd с энергиями связи уровня Pd 3d5/2 равными 337,9 и 335,7 эВ. Первое состояние указывает на образование комплекса, так как согласно [189] энергии связи уровня Pd 3d5/2 во всесторонне изученных комплексах PdII - Pd(PPh)2Cl2, Pd(PPh)2Br2 равны 338,0 и 337,9 эВ, соответственно. К тому же значения энергии связи в комплексах на полимерах чётко соответствуют энергии связи (337,9 эВ) уровня Pd 3d5/2 для аналогичного низкомолекулярного комплекса 13, строение которого также доказано с использованием методов ЯМР- и масс-спектроскопии, а состав подтверждён данными элементного анализа. Второе состояние (335,7 эВ) в спектре указывает на частичное разложение комплексов под действием рентгеновского излучения (положение пика Pd 3d5/2 соответствует состоянию Pdd+, где d<1 и близко к Pd0). Доля второго сигнала в полимере на основе циклотримера (14) составляет 1/7, в Pd-ПФИ-2-5 – 1/8 часть, а в ТП-1 всего 1/10.
Таким образом, были получены модельное соединение (13) и серия полимеров с иммобилизованными N-гетероциклическими карбеновыми комплексами на основе N-метилимидазола и ПФ 3-ех видов: на основе тримеров (14, 15), разветвлённые ПФ (серия Pd-ПФИ) и сшитые ПФ (Pd-ТП-1, Pd-ТП-2), как первый пример использования ПФ в качестве матриц для иммобилизации карбеновых комплексов палладия.
Не нашли, что искали? Воспользуйтесь поиском: