
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Втрое начало термодинамики.
Согласно теореме Карно,
 или
или 
 .
.
Следовательно,
 или
или  .
.
Умножим обе части последнего неравенства на дробь  , получим
, получим
 или
или 
 или
или 
 ,
,
где 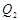 – теплота, отданная холодильнику;
– теплота, отданная холодильнику;  – теплота, принимаемая рабочим телом от холодильника. Отношение количества теплоты, полученного системой от какого-либо тела, к температуре этого тела
– теплота, принимаемая рабочим телом от холодильника. Отношение количества теплоты, полученного системой от какого-либо тела, к температуре этого тела  , Клаузиус назвал приведённым количеством теплоты.
, Клаузиус назвал приведённым количеством теплоты.
Последнее неравенство, называется неравенством Клаузиуса: сумма элементарных приведённых количеств теплоты, полученных системой в ходе цикла извне, равна нулю, если цикл обратим и меньше нуля, если необратим:
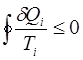 . (6.24)
. (6.24)
Энтропия
Пусть  – элементарное количество теплоты, сообщаемое нагревателем системе при малом изменении ее состояния, а
– элементарное количество теплоты, сообщаемое нагревателем системе при малом изменении ее состояния, а  – температура нагревателя. Если процесс обратим, то температура системы тоже равна
– температура нагревателя. Если процесс обратим, то температура системы тоже равна  . Обозначим через
. Обозначим через  элементарное приведённое количество теплоты
элементарное приведённое количество теплоты 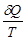 в обратимом процессе:
в обратимом процессе:
 , (6.25)
, (6.25)
где  – энтропия. Можно показать, что энтропия
– энтропия. Можно показать, что энтропия  является функцией состояния системы, в отличие от теплоты
является функцией состояния системы, в отличие от теплоты  , являющейся функцией процесса.
, являющейся функцией процесса.
Утверждение о том, что энтропия изолированной (т.е. предоставленной самой себе) системы может только возрастать, а при достижении максимального значения оставаться постоянной носит название закона возрастания энтропии или II начала термодинамики.
Свойства энтропии:
1) По характеру изменения энтропии можно судить о направлении процесса теплообмена. Действительно, из (2.3.7) следует, что  и
и  имеют один и тот же знак. Следовательно, если энтропия системы возрастает (
имеют один и тот же знак. Следовательно, если энтропия системы возрастает ( ), значит, ей сообщили какое-то количество теплоты (
), значит, ей сообщили какое-то количество теплоты ( ); если энтропия убывает (
); если энтропия убывает ( ), значит, у неё отобрали теплоту (
), значит, у неё отобрали теплоту ( ).
).
2) В термодинамике доказывается, что э нтропия изолированной системы может только возрастать, если в ней протекают необратимые процессы, или оставаться постоянной, если процессы обратимы. Убывать энтропия не может:
 . (6.27)
. (6.27)
3) Обратимый адиабатный процесс является изоэнтропным (он протекает без изменения энтропии). Цикл Карно, состоящий из двух изотерм и двух адиабат, можно рассматривать как цикл, состоящий из двух изотерм и двух изоэнтроп. На  диаграмме (рис.4.5) он изображается в виде прямоугольника, стороны которого параллельны осям координат. Из формулы
диаграмме (рис.4.5) он изображается в виде прямоугольника, стороны которого параллельны осям координат. Из формулы 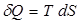 следует, что теплота
следует, что теплота  , полученная системой от нагревателя при протекании изотермического процесса 1 – 2, равна:
, полученная системой от нагревателя при протекании изотермического процесса 1 – 2, равна:
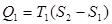 , (6.28)
, (6.28)
 Рис.6.4 Работа в цикле
Карно Рис.6.4 Работа в цикле
Карно
| где  – энтропия системы в начале процесса, – энтропия системы в начале процесса,  – энтропия в конце процесса. Теплота – энтропия в конце процесса. Теплота 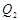 , отданная холодильнику в изотермическом процессе 3 - 4, равна , отданная холодильнику в изотермическом процессе 3 - 4, равна
 . (6.29)
Общее количество теплоты, полученной системой за цикл . (6.29)
Общее количество теплоты, полученной системой за цикл
 , (6.30)
определяется площадью прямоугольника, заштрихованного на рисунке. , (6.30)
определяется площадью прямоугольника, заштрихованного на рисунке.
|
4) В табл.6.1 приведены выражения для изменения энтропии в различных процессах перехода идеальных газов из состояния 1 в состояние 2.
Таблица 4.1
Изохорный
( ) )
| Изобарный
( ) )
| Изотермический
( ) )
| Адиабатный
( ) )
|
 , ,

| 

| 

|
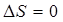
|
Они выведены из формулы
 ,
,
(6.31)
которая получена из выражения для изменения энтропии в равновесных процессах:
 ,
,
где 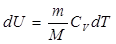 ,
,  .
.
Для вывода формулы использованы выражения:  и
и  .
.
5) Энтропия является мерой связанной энергии. В обратимом изотермическом процессе работа совершается за счёт убыли свободной энергии  системы
системы
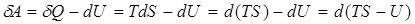
или
 , (6.32)
, (6.32)
где  – свободная энергия системы (энергия Гельмгольца).
– свободная энергия системы (энергия Гельмгольца).
Величина 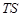 представляет собой ту часть внутренней энергии системы, которая не может быть превращена в работу в обратимом изотермическом процессе. Это как бы «обесцененная» часть внутренней энергии, которую часто называют связанной энергией. При одной и той же температуре величина связанной энергии тем больше, чем больше энтропия системы.
представляет собой ту часть внутренней энергии системы, которая не может быть превращена в работу в обратимом изотермическом процессе. Это как бы «обесцененная» часть внутренней энергии, которую часто называют связанной энергией. При одной и той же температуре величина связанной энергии тем больше, чем больше энтропия системы.
6) Энтропия является мерой вероятности состояния термодинамической системы. Термодинамическая вероятность 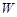 состояния системы определяется количеством способов реализации этого состояния. Или, иначе говоря, вероятность определённого макросостояния равна числу всевозможных микросостояний (микрораспределений частиц по координатам и скоростям, соответствующих данному состоянию), которыми оно может быть осуществлено. Термодинамическая вероятность
состояния системы определяется количеством способов реализации этого состояния. Или, иначе говоря, вероятность определённого макросостояния равна числу всевозможных микросостояний (микрораспределений частиц по координатам и скоростям, соответствующих данному состоянию), которыми оно может быть осуществлено. Термодинамическая вероятность  , поэтому она не является вероятностью в математическом смысле, которая меньше единицы.
, поэтому она не является вероятностью в математическом смысле, которая меньше единицы.
Больцман доказал, что между величиной термодинамической вероятности 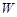 системы и величиной её энтропии
системы и величиной её энтропии  существует зависимость, которая называется формулой Больцмана:
существует зависимость, которая называется формулой Больцмана:
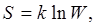 (2.3.14)
(2.3.14)
энтропия какого-либо состояния системы определяется логарифмом числа микросостояний, которыми это состояние может быть реализовано.
Не нашли, что искали? Воспользуйтесь поиском: