
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
ОСМОТИЧНИЙ ТИСК В РОЗЧИНАХ НЕЕЛЕКТРОЛІТІВ ТА ЕЛЕКТРОЛІТІВ
Осмотичним тиском називається тиск, що спостерігається в розчинах і викликуваний ударами часток розчиненої речовини (молекул, сольватів, гідратів, іонів), що знаходяться в безладному тепловому русі, о стінки судини.
Безпосередньо знайти та вимірити його не можна, так як о стінки судини одночасно ударяються не тільки частки розчиненої речовини, але й молекули розчинника. Для виміру осмотичного тиску необхідно відділити розчин від чистого розчинника за допомогою напівпроникної перегородки, здатної пропускати розчинник і затримувати частки розчиненої речовини. Властивістю напівпроникненості володіють пергамент, целофан і ряд інших матеріалів.
Прилади, що вимірюють осмотичний тиск, називаються осмометрами.
Основною частиною осмометра напівпроникна перегородка.
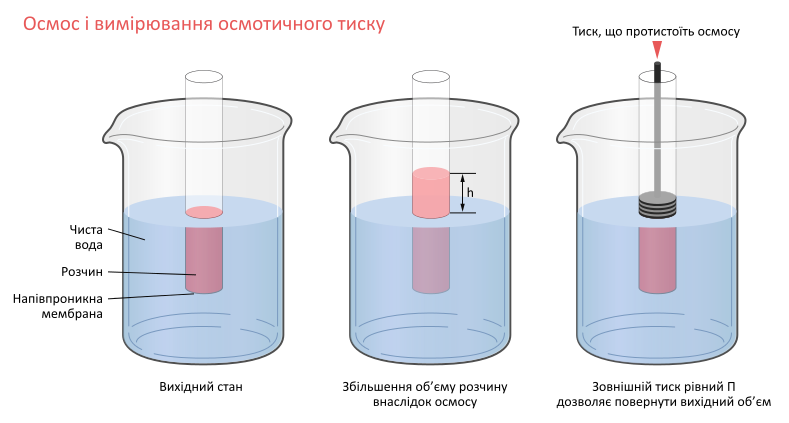
В осмометрі протікає процес дифузії.
Дифузія – направлений процес. Він здійснюється через перегородку із судини з розчином з більшою концентрацією в чистий розчинник.
Переміщення розчину в бік розчинника, виникаюче при наявності напівпроникної перегородки, називається осмосом. Частки розчиненої речовини перейти в розчинник не можуть. Вони ударяються о перегородку і створюють осмотичний тиск. Його визначають, визначивши додатковий тиск, який потрібно прикласти до розчину, щоб запобігти переходу молекул розчинника в розчин. Він дорівнює добутку щільності розчину на різницю рівнів висоти в трубці і судині з розчинником.
Таким чином, в осмометрі діють дві протилежні сили – сила осмотичного тиску, що сприяє усмоктуванню розчинника усередину, і гідростатичний тиск стовбура рідини в осмометрі, що перешкоджає і припиняє всмоктування розчинника.
На підставі досвідчених даних установлено, що розведені розчини доволі добре підпорядковуються законам ідеального газу, і ці закони для них мають вигляд:
· Закон Бойля- Маріотта: осмотичний тиск розчинів при постійній температурі змінюється прямо пропорційно їх концентрації:
p1/С1 = p2/С2; p/С = const
· Закон Шарля: осмотичний тиск розчинів прямо пропорційний абсолютній температурі при постійній концентрації:
p1/Т1 = p2/Т2; p/Т = const
· Закон Авогадро: розчини різних речовин при однакових концентраціях і температурах володіють однаковим осмотичним тиском (ізотонічні розчини).
Крім того, універсальна газова постійна, обчислена за величиною осмотичного тиску при заданій температурі і концентраціях розчинів, має те ж числове значення, що і для газів.
Звідси рівняння Клапейрона-Менделєєва для розведених розчинів можна записати так:
p = СRT
где p - осмотичний тиск (Па), С – концентрація (кмоль/м3), R– універсальна газова постійна (Дж/кмоль*К).
Справедливість цього закону була доведена Вант Гоффом. Він є основним законом для розведених розчинів і формулюється наступним чином:
Осмотичний тиск розчиненої речовини в розведеному розчині дорівнює тому газовому тиску, який робила б ця речовина, якби у вигляді газу займала б той же об’єм, що і розчин (ЗАКОН ВАНТ ГОФФА).
Але цей закон справедливий тільки для розведених розчинів.
Відхилення від закону Вант Гоффа спостерігається у розчинів електролітів: кислот, лугів, солей. У них визначене дослідним шляхом p вище, ніж обчислене. Для приведення в дійсне співвідношення, вводять ізотонічний коефіцієнт i- він показує, у скільки разів дослідний осмотичний тиск вищий за обчислений за допомогою закону Вант Гоффа: i =pдос/pвир.
Для розчинів електролітів закон Вант Гоффа має вигляд:
p = iСRT
Ступінь дисоціації a = х /N, де х - кількість дисоційованих молекул, N – загальна кількість молекул.
Збільшення кількості часток в розчині (за рахунок дисоціації) характеризується величиною ізотонічного коефіцієнту:
N + Na
i = ---------- або i = 1 +a
N
Зі зростанням a збільшується і i. При нескінченно великому розведенні a= 1, а i = const. Для загального випадку
i = 1 + (k – 1) a
де k – кількість іонів, що утворились при дисоціації.
У сильних електролітів говорять про удавану ступень дисоціації. Насправді вона дорівнює1.
Розрізняють також ефективну концентрацію, або активність. Активність електроліту для нескінченно розведених (ідеальних) розчинів менше або більше концентрації. Відношення активності і концентрації електроліту називається коефіцієнтом активності:
f = a /C
Він показує ступінь відхилення реального розчину від ідеального. Звичайно f<1. З розведенням він прагне до 0.
Також існує поняття іонної сили розчину – це міра напруженості електричного поля, існуючого в розчині:
m= ½ (C1Z12 + C2Z22 + …+ CnZn2)
деC1, C2, Cn– концентрації окремих, існуючих в розчині іонів, Z1, Z2 , Zn- їх ступені окислення.
Не нашли, что искали? Воспользуйтесь поиском: