
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
ХИМИЯ СИЛИКАТНЫХ ИЗДЕЛИЙ
МИНИСТЕРСТВО ОБРАЗОВАНИя И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ДИЗАЙНА И ТЕХНОЛОГИИ»
(ФГБОУ ВПО «МГУДТ»)
ХИМИЯ СИЛИКАТНЫХ ИЗДЕЛИЙ
Конспекты лекций
Для бакалавров по направлению 38.03.07 (100800) Товароведение
Составитель: А.П.Ярутич, к.т.н.
Москва
МГУДТ 2016
Рассмотрены темы: химия силикатов, их строение и свойства, особенности строения и свойств стекла и изделий из него; керамических: фарфоровых и фаянсовых изделий. Предназначена для бакалавров очной формы обучения по направлению 38.03.07 (100800) Товароведение.
СОДЕРЖАНИЕ
| стр | |
| Тема 1 Свойства силикатов. Состав и химические свойства стекла | |
| Тема 2 Влияние химического состава стекла на его физические свойства и характеристики | |
| Тема 3 Основы производства стеклянных изделий | |
| Тема 4 Окрашивание стекла | |
| Тема 5 Декорирование, классификация, показатели качества стеклянных изделий | |
| Тема 6 Керамические изделия. Фарфор. Состав, свойства, основы производства. Глазури. Дефекты фарфоровых изделий | |
| Тема 7 Керамические изделия. Фаянсовые изделия. Тонкокаменные и полуфарфоровые изделия. Майолика. Гончарные изделия | |
| Тема 8 Силикатные изделия специального назначения. архитектурно-строительные, технические и др. | |
| Список литературы |
Тема 1. Свойства силикатов. Состав и химические свойства стекла
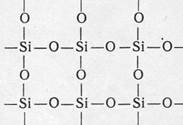
Диоксид кремния (кремнезём) SiO2 – соединение кремния с кислородом (Рис 1). Является ангидридом кремниевых кислот nSiO2 . mH2O.
SiO2 – наиболее распространённое в земной коре соединение, составляющее в виде различных минералов 12 % её массы. Основной минерал – кварц – встречается повсюду в виде обычного песка (SiO2) с примесями оксидов железа и алюминия. А яшма, халцедон, агат, сердолик – так называемые полудрагоценные камни – всё это разновидности кварца. Они отличаются природой и количеством примесей.
Кристаллический SiО2 – очень твердое, прочное, тугоплавкое вещество tпл=1610 °С при быстром нагреве, 1723 °С – при медленном). При остывании расплавленного SiO2 образуется аморфное кварцевое стекло.
Кислоты не действуют на SiO2. Лишь фтористоводородная кислота постепенно растворяет его:
SiO2 + 6HF = H2SiF6 + 2Н2О
В растворах щелочей SiO2 медленно переходит в соли кремниевых кислот, например:
nSiO2 + 2КОН = К2О . nSiO2 + Н2О
При сплавлении SiO2 с оксидами, гидрооксидами, карбонатами металлов образуются силикаты. Так, в процессе стекловарения идут реакции, которые можно выразить суммарным уравнением:
СаСОз + Na2CO3 + 6SiO2 = Na2O . CaO . 6SiO2 + 2СО2
На варку стекла и производство бетона идёт большая часть добываемого кварцевого песка (до 95 %). Чистый кварц незаменим в приборостроении.
Таким образом силикатами являются соли кремниевых кислот (nSiO2·mН2О), получаемые сплавлением кремнезема со щелочами и карбонатами. Они содержат соединения SiO2 с другими оксидами СаО, PbO и др. Силикаты бывают простые и сложные. К простым силикатам относятся соединения кремнезема с оксидами калия или натрия, примером их может служить растворимое стекло Na2SiO3. Сложными являются такие соединения, как Al2O3·2SiO2·2H2O – каолинит, 3Al2O3·2SiO2 – муллит, а также различные породы и минералы, например, гранит.
Силикатные материалы делят на природные и искусственные. К природным относятся различные горные породы (гранит, глина, песок, каолин и др.), состоящие из минералов, которые характеризуются постоянным составом, выраженным кристаллическим строением и определенными свойствами. Горные силикатные породы широко применяют как основной строительный материал и в виде сырья для производства других изделий. Например, песок является основным сырьем для получения стекла; глина и каолин – для производства керамических изделий.
Силикатные изделия благодаря содержанию кремнезема характеризуются рядом общих и характерных для них свойств. Они обладают высокой химической стойкостью, гигиеничностью, разрушающим напряжением при сжатии и термическим расширением. Для них характерны малые теплопроводность и термическая стойкость, невысокое разрушающее напряжение при изгибе, растяжении и ударе (при ударах они быстро разрушаются). Химическая стойкость силикатов возрастает с повышением количества кремнезема и уменьшается с увеличением содержания оксидов одновалентных элементов. Силикатные изделия хорошо сопротивляются растворам кислот и щелочей, за исключением плавиковой кислоты, под действием которой они разрушаются.
Невысокая теплопроводность и большое термическое расширение силикатных изделий обусловливают их малую термическую стойкость. При резких колебаниях температуры они быстро разрушаются. Низкая сопротивляемость силикатных изделий перепадам температуры объясняется следующим. Кремнезем в природе встречается в различных модификациях. Переход одной модификации в другую при резких колебаниях температуры сопровождается изменением объема (в 2,5-3 раза), что способствует образованию в толще изделий больших внутренних напряжений, приводящих к разрушению.
Состав стекла.
Под стеклом понимают вещества аморфно-кристаллитной структуры, получаемые путем переохлаждения расплава, состоящего из различных оксидов, и независимо от их химического состава и температурной области затвердевания обладающие при постепенном повышении вязкости механическими свойствами твердых тел. Переход из жидкого состояния в стеклообразное является обратимым. Химический состав стекла различен в зависимости от требований, предъявляемых к свойствам стеклоизделий, от условий их эксплуатации, а также способа выработки.
Состав стекла может быть выражен общей формулой трисиликата R2O·RO·6SiO2. Из одновалентных оксидов в состав стекла входят оксиды натрия, калия, лития и другие; из двухвалентных – кальция, магния, свинца и другие. В настоящее время в стеклоделии используют около 80 элементов периодической системы Д. И. Менделеева, в том числе и редкоземельные, которые широко применяют в качестве красителей. Стекла представляют собой сложные системы, состоящие не менее чем из пяти оксидов. Основными являются SiO2 – 72-75 %, CaO – 8,5-9,5 и Na2O –13-15 %, а также оксиды фосфора, бора, алюминия и др. Названия стекол зависят от содержания в них тех или иных оксидов: натрий-кальций-силикатные, фосфатные, свинцовые (хрустальные), бариевый хрусталь и т. д. Для получения изделий с необходимыми свойствами с учетом их назначения изменяют химический состав стекла (Таблица 1). Так, при замене оксида натрия оксидом калия стекло приобретает повышенный блеск и чистый оттенок, из такого стекла вырабатывают сортовую посуду методом выдувания. При введении в калиево-известковое стекло оксидов свинца, имеющих повышенный коэффициент преломления, получают изделия, характеризующиеся наряду с блеском своеобразной игрой света и повышенной плотностью. Эти изделия называют хрустальными.
Таблица 1
Химический состав стекол в зависимости от вида бытовых изделий
| Оксид | Содержание оксидов в стекле, % | |||
| для выдувных изделий | для пресованных изделий | для кухонной посуды (жаропрочная) | для хрустальных изделий | |
| SiO2 | 73-75 | 73-74 | ||
| Na2O | 13,5-15,5 | 13,5-15,5 | - | ≤ 4,0 |
| K2O | 1,5-2,5 | 1,0-2,0 | - | 14,0-16,5 |
| CaO | 6,5-8,5 | 7,0-8,0 | 10,0 | ≤ 1,0 |
| MgO | 1,0-2,0 | 2,0-2,5 | 4,0 | - |
| Al2O3 | 0,3-0,5 | 0,5-2,0 | 17,5 | до 1,0 |
| Fe2O3 | ≤ 0,03 | ≤ 0,03 | ≤ 0,1 | ≤ 0,01 |
| ZnO | - | - | 2,5 | ≤ 1,0 |
| BaO | - | - | 1,5 | - |
| B2O3 | - | - | 5,2 | 0,5-1,0 |
| TiO2 | - | - | 1,0 | - |
| PbO | - | - | - | 18,0-24,0 |
Стекло характеризуется избирательной химической устойчивостью к различным реагентам. Она зависит от химического состава стекла, и прежде всего от содержания в нем кремнезема и щелочных оксидов. С увеличением количества кремнезема химическая устойчивость стекла повышается, щелочные оксиды способствуют ее понижению. Химическая устойчивость стекла, в которое входят два щелочных оксида, выше, чем стекла, содержащего эквивалентное количество одного из этих оксидов.
Более устойчивыми являются силикаты двухвалентных металлов (кальциевые и магниевые), малоустойчивыми – силикаты бария и свинца. Химическая устойчивость стекла возрастает также с увеличением содержания в нем алюминатов и боросиликатов (до 12%).
Химическая стойкость стекла, как указывалось выше, тем больше, чем меньше содержание щелочных оксидов. Однако при значительном уменьшении количества этих оксидов резко повышается вязкость и в связи с этим температура варки и осветления стекломассы.
Устойчивость стекла к растворам кислот тем выше, чем больше содержание SiO2, Al2O3, ZrO2, а к щелочам – SiO2, CaO. С увеличением в стекле BaO, MgO щелочестойкость снижается. Стекло хуже сопротивляется воздействию NaOH, чем КОН.
Высокая химическая устойчивость стекла объясняется гидролизом силикатов его поверхности при взаимодействии с влагой. Образующиеся при этом едкая щелочь и гель кремниевой кислоты остаются на поверхности стекла в виде равномерной пленки толщиной до 7 мкм. Слой геля кремниевой кислоты по мере увеличения его толщины замедляет процесс разрушения поверхности стекла. Скорость разрушения силикатного стекла зависит от скорости гидролиза силикатов и скорости диффузии воды и продуктов разрушения через защитную пленку.
На поверхности стекол, не содержащих кремнезем (боратных и фосфатных), под действием химических реагентов защитная пленка не образуется. В результате воздействия на стекло едкой щелочи с углекислотой воздуха образуются карбонаты, которые постепенно накапливаются, образуя мелкие капли или сплошной налет. Установлено, что скорость разрушения поверхности стекла снижается по мере образования на ней защитной кремнеземной пленки и что химическая устойчивость стекла зависит от толщины, плотности и химического состава пленки. Под действием плавиковой кислоты защитная пленка геля кремниевой кислоты постепенно переходит в растворимый четырехфтористый кремний.
Щелочно-известковые стекла по химической устойчивости делят на три группы (Таблица 2).
Таблица 2
Химическая стойкость стекла в зависимости от химического состава
| Группа химической устойчивости стекла | Состав стекла, % | |
| Na2O+K2O | CaO | |
| Хорошая | <13 | 12-16 |
| Средняя | 13-19 | 7-12 |
| Низкая | >19 | 3,5-7,0 |
Стекла с высокой химической устойчивостью, как правило, имеют высокие механические и электроизоляционные свойства.
Химическая устойчивость стекла повышается в несколько десятков раз в результате тепловой обработки (400-450 °С) его поверхности, при которой происходит уплотнение кремнеземной пленки.
Демонстрационные опыты:
Опыт 1. Исследование химических свойств и состава стекла.
Помещаем несколько капель раствора фенолфталеина на образец стеклянного боя в фарфоровой ступке. Добавляем небольшое количество воды с температурой более 90˚С. Наблюдаем изменение цвета индикатора. Наличие какого оксида в составе стекла демонстрирует опыт? Сделайте выводы.
Опыт 2. Исследование химических свойств и состава хрусталя.
Помещаем образец хрустального боя в фарфоровую ступку, добавляем 10-15 мл 15% уксусной кислоты, нагреваем не доводя до кипения в течение 30 мин (Опыт проводится под тягой!!!). После полного охлаждения смесь необходимо профильтровать. К фильтрату, разделенному на две части добавьте несколько капель раствора сульфида натрия (Опыт проводится под тягой!!!), и раствора хромата калия. Что наблюдается? Наличие какого оксида в составе хрусталя демонстрирует опыт? Сделайте выводы.
Тема 2. Влияние химического состава стекла на его физические свойства и характеристики
Стекло характеризуется изотропностью свойств. Применение тех или иных стеклянных изделий зависит от их свойств, основными из которых являются физические и химические. Наиболее важными с точки зрения производства, назначения и условий эксплуатации изделий следует считать физические свойства – физико-механические, термические, оптические, электрические.
Физические свойства. Показатели ряда физических свойств стекла могут быть определены расчетным путем по правилу слагаемости (аддитивности), согласно которому числовое значение свойства стекла может быть получено сложением числовых значений отдельных оксидов, входящих в его состав. Несмотря на то, что результаты определения свойств по правилу слагаемое имеют приближенное значение, оно дает возможность получить изделия с необходимыми показателями свойств. Таким образом, изменяя химический состав стекла, можно придавать готовым изделиям те или иные свойства.
Основными физико-механическими свойствами являются вязкость, поверхностное натяжение, плотность, упругость, прочность при растяжении и сжатии, хрупкость, твердость. Вязкость и поверхностное натяжение характеризуют стекло в жидком состоянии, остальные свойства – в твердом.
Вязкость, или коэффициент внутреннего трения, характеризует способность частиц перемещаться внутри данного вещества в зависимости от температуры. Она имеет важное значение для варки, формования и отжига стекла и на отдельных этапах этих процессов должна быть строго определенной.
Вязкость стекла зависит от природы и количества оксидов, входящих в его состав. Повышают вязкость стекла оксиды алюминия, цинка, кремнезем. Оксиды кальция и бора понижают вязкость при высоких температурах и повышают при низких, при этом сокращается время выработки изделий. Оксиды натрия, калия, магния, марганца, свинца, бария разжижают стекло, в результате время изготовления изделий увеличивается. При замене оксида кальция оксидом магния вязкость стекла при высокой температуре увеличивается.
Вязкость стекла выражается в паскаль-секундах (Па∙с). 1 Па∙с – это вязкость потока жидкости, в котором линейная скорость под воздействием давления сдвига в 1 Н/м2 имеет градиент в 1 м/с на 1 м расстояния, перпендикулярного плоскости сдвига.
Вязкость стекла при варке (при температуре 1450–1500 °С) составляет от 10 до 102 Па∙с, при формовании (1180 °С) – от 103 до 109 Па∙с. Благодаря высокой вязкости из стекла можно изготовлять изделия различных размеров и формы.
Поверхностное натяжение. В поверхностных слоях стекла между отдельными молекулами или частицами возникают большие натяжения, превышающие натяжения во внутренних слоях. Поэтому на поверхности стекла образуется как бы пленка с уплотненным расположением частиц, стремящихся сократить эту поверхность. Это явление и называется поверхностным натяжением. На этом свойстве стекла основаны получение при формовании стеклоизделий с гладкой и блестящей поверхностью, а также огневая полировка поверхности.
Поверхностное натяжение существенно влияет на удаление различных газовых и воздушных включений из стекломассы в процессе варки. Наилучшее осветление стекломассы достигается при понижении поверхностного натяжения. Поверхностное натяжение натриево-силикатных стекол с увеличением содержания SiO2 снижается, свинцово-силикатных – возрастает. Двухвалентные оксиды металлов не оказывают заметного влияния на него. К2О, РbО, В2О3, Сr2О3 способствуют понижению поверхностного натяжения натриево-известкового стекла.
Поверхностное натяжение стекла определяется работой, которую необходимо совершить для образования единицы новой поверхности, и равняется 0,22-0,36 Н/м2. Поверхностное натяжение расплавленного стекла в 3-4 раза выше, чем воды.
Плотность стекла как массы в единице объема зависит от плотности входящих в него компонентов и колеблется от 2,2 до 6,0 г/см3. По плотности можно примерно определить природу стекла. Например, плотность чисто кварцевого стекла равна 2,2 г/см3, натриево-известкового – 2,4-2,5, хрустального – 2,5-2,9 г/см3 и более.
Наибольшую плотность имеют стекла, содержащие оксиды тяжелых металлов – PbO, BaO, ZnO. Плотность стекла зависит также от температуры: при повышении температуры она понижается. Кроме того, на плотность влияет состояние кварца: если кварц находится в кристаллическом состоянии, то плотность стекла равна 2,65 г/см3, а если в стекловидном – 2,2 г/см3. На плотность стекла заметно влияет и термическая обработка изделий. Так, плотность отожженного стекла примерно на 0,5 % больше, чем закаленного.
Упругость стекла характеризуется модулем упругости Юнга – Е, который определяют по стреле прогиба для образца прямоугольного сечения. Величина модуля упругости стекол различного химического состава колеблется от 470 до 860 МПа; кварцевого стекла – от 650 до 720 МПа. Повышают модуль упругости СаО и В2О3 (до 12 %), а также MgO, ZnO, BaO, PbO, A12O3; щелочные оксиды снижают его. С помощью модуля упругости можно характеризовать термические и прочностные свойства изделий. Чем больше модуль упругости стекла, тем выше его прочность, меньше деформация, которую способен выдержать образец за счет возникающих в нем больших напряжений, и термическая стойкость.
Прочность – один из важнейших показателей механических свойств, определяющий возможность использования стекла при механических нагрузках. Различают прочность при растяжении, сжатии, изгибе, ударе и т. д. Стекло неодинаково ведет себя при различных видах нагрузки. Оно хорошо сопротивляется сжатию и хуже растяжению и изгибу. Разрушающее напряжение при сжатии для стекла равно 50-200 МПа, что в 15-20 раз больше прочности при растяжении. На повышение прочности при сжатии положительно влияют оксиды алюминия, магния, кремнезем. Щелочные оксиды оказывают отрицательное влияние. Разрушающее напряжение при растяжении колеблется от 3,5 до 9МПа и зависит от химического состава стекла, состояния поверхности и диаметра образца. Наличие на поверхности мельчайших трещин и царапин резко снижает прочность при растяжении. Прочность стеклянных нитей сильно повышается с уменьшением их диаметра, особенно менее 8 мкм. Так, при уменьшении диаметра нити от 0,1 до 0,03 мкм разрушающее напряжение возрастает от 5 до 10 МПа.
Прочность при растяжении повышается при наличии в стекле СаО, ВаО, РbО и А12О3. При содержании оксида бора до 15 % прочность повышается, свыше 15 % – резко снижается.
Прочность стекла может быть повышена путем термической обработки – закалки, полировки, травления, ионным обменом и другими способами. Прочность закаленного стекла в 3-4 раза выше, чем отожженного, так как при закалке в поверхностном слое создаются большие, но равномерно распределенные напряжения, которые и ослабляют расклинивающее действие трещин и царапин.
В результате предварительной обработки поверхности стекла плавиковой кислотой или смесью растворов солей устраняются дефекты поверхности и упрочняется поверхностный слой за счет изменения химического состава, при этом прочность стекла при растяжении повышается в 4-5 раз.
Увеличение прочности стекла при воздушной закалке объясняется повышением напряжений сжатия в поверхностных слоях, а также некоторыми структурными особенностями, что подтверждается определением спектров поглощения.
Между степенью закалки и его физико-механическими свойствами существует сложная зависимость.
Прочность стекла повышается и при огневой полировке поверхности, в результате которой заплавляются микротрещины.
При кислотном травлении прочность стержней из натриево-известкового стекла возрастает со 100 до 2100 МПа. Однако быстрое охлаждение их в масле снижает прочность до 700 МПа, что объясняется образованием на поверхности стекла новых микротрещин. После повторного травления прочность стержней восстанавливается; при этом имеет значение глубина поверхностных трещин. При глубине травления на 10-15 мкм (при снятии слоя стекла на эту толщину) прочность повышается.
Перспективным методом упрочнения стекла является закалка в кремнийорганических жидкостях с последующим травлением в 20 %-ном растворе плавиковой кислоты. При этом на поверхности стекла образуется кремнийкислородная полимерная пленка и устраняются микротрещины, в результате чего прочность стекла повышается в несколько раз.
Напряжения в поверхностном слое увеличиваются при введении в него методом диффузии ионов лития, вытесняющих ионы калия и натрия. При содержании в стекле определенного количества глинозема и кремнезема могут образоваться кристаллы β-сподумена, которые повышают напряжения сжатия, обусловливающие увеличение прочности. Так, прочность стекла на изгиб повышается до 100-140 МПа. С увеличением прочности повышается термическая стойкость стекла.
Хрупкость – способность стекла разрушаться под действием ударной нагрузки, превышающей разрушающее напряжение, без обнаружения явлений течения. Хрупкость является важным показателем, характеризующим долговечность изделий. Она выражается работой (S, Дж/м3), которая затрачивается на разрушение образца.
Стекло – хрупкий материал, что ограничивает его применение. Хрупкость разных по составу стекол неодинакова. Так, хрупкость оконного стекла равна 0,1-0,25 МПа, а хрустального значительно выше. При содержании В2О3 до 15 % хрупкость снижается в 6-7 раз, свыше 15 % – резко возрастает. Понижению хрупкости способствуют также MgO, A12O3, SiO2.
Хрупкость стекла во многом зависит от толщины образца, степени его однородности и термической обработки. С увеличением толщины и однородности сопротивление образца удару возрастает. Прочность на удар закаленных стекол повышается в 5-7 раз. Эту особенность используют при выработке изделий бытового назначения и листового стекла для автотранспорта.
Твердость – способность стекла сопротивляться внедрению в него другого тела под определенной нагрузкой. Она имеет важное значение для определения видов и средств механической обработки изделий и их использования. Самыми твердыми являются кварцевые, высокоглиноземистые (от 18 до 30 % Аl2Оз) и боросиликатные (до 12 % В2О3) стекла, самыми мягкими – хрустальные и богатые щелочными оксидами. Чем выше твердость стекла, тем меньше царапин и повреждений образуется на поверхности изделий, дольше сохраняется блеск и выше механическая прочность.
Твердость стекла определяют различными методами: вдавливанием и царапанием, шлифованием и др. По минералогической шкале твердость стекла между 5-7 (апатитом и кварцем). Она может быть повышена путем термической обработки.
Термические свойства стекла имеют важное значение при оценке качества готовых изделий и определении условий их использования. Основными являются теплоемкость, теплопроводность, термическое линейное и объемное расширение и термическая стойкость.
Теплоемкость стекла зависит от химического состава и природы молекулярных связей. Между химическим составом и теплоемкостью существует линейная зависимость. Теплоемкость повышается с увеличением содержания в стекле ZnO, Li2О и В2О3 и снижается при введении РbО и ВаО. С повышением температуры она увеличивается, особенно в интервале внутриструктурных превращений. Теплоемкость стекла находится в пределах от 0,3 до 1,05 кДж (кг·°С). Определяют ее с помощью колориметров и вычисляют по правилу слагаемости.
Теплопроводность стекла весьма невелика и составляет 0,7-1,34 Вт (м·°С), что в 400 раз меньше теплопроводности меди. Она зависит от химического состава стекла. При замене кремнезема другими оксидами теплопроводность уменьшается. С повышением температуры она возрастает, при нагревании до температуры размягчения стекла – удваивается. Поэтому теплопроводность следует учитывать в определенных интервалах температур. Она прямо пропорциональна теплоемкости.
Теплопроводность стекла положительно влияет на его термическую стойкость, которая с увеличением теплопроводности повышается. При резких колебаниях температуры возникают большие напряжения между внутренними и внешними слоями стекла, имеющего малую теплопроводность. При одной и той же разности температур они тем выше, чем ниже теплопроводность, это необходимо учитывать при выработке изделий из стекла.
Термическое расширение характеризуется коэффициентами линейного и объемного расширения, которые показывают, как изменяется по длине или объему образец стекла при нагревании на 1 °С. Объемный коэффициент термического расширения равен трем коэффициентам линейного расширения.
Термическое расширение стекла имеет важное значение при определении режимов горячей обработки изделий и их эксплуатации, получении цветных, двух- и многослойных изделий, электроламп, спекании стекла с различными металлами и керамикой и т. д. Во всех этих случаях коэффициенты термического расширения стекол и других материалов должны быть одинаковыми и строго согласованными между собой не только по абсолютной величине, но и по характеру изменения при разных температурах. Коэффициент термического расширения зависит от химического состава стекла и температуры. Щелочные оксиды резко повышают его, a SiO2, B2O3, MgO заметно снижают. Величина термического расширения стекла колеблется от 5,8-10-7 (кварцевого стекла) до 70-90-10-7 (стекол обычного состава). Термическое расширение отрицательно влияет на термическую стойкость стекла: чем оно выше, тем хуже стекло переносит колебания температуры.
Термическая стойкость – способность стеклоизделий выдерживать резкие колебания температуры не разрушаясь. Она имеет большое значение для оценки качества бытовых и технических изделий, влияет на их долговечность. Она зависит от целого ряда факторов и свойств стекла: термического расширения, теплопроводности, прочности при растяжении, модуля упругости, теплоемкости, толщины и формы изделий, степени однородности стекла и т. д. Поэтому следует определять термическую стойкость готовых изделий при перепадах температур, соответствующих реальным условиям их эксплуатации. Характеризуется она количеством теплосмен, которое выдерживает изделие при соответствующих перепадах температур. О термостойкости судят также по разности температур до разрушения изделий и по другим признакам.
Термическая стойкость тем выше, чем ниже термическое расширение, больше теплопроводность и прочность при растяжении. Наибольшей термической стойкостью характеризуется кварцевое стекло с малым термическим расширением. С увеличением модуля упругости, степени неоднородности стекла по составу и толщины изделий термическая стойкость понижается. Высокую термическую стойкость имеют изделия с малым содержанием щелочных оксидов и большим количеством оксидов бора, титана и др. Термическая стойкость стеклоизделий зависит также от состояния их поверхности: при наличии царапин, трещин и других дефектов она снижается. Для устранения дефектов, а следовательно, для повышения термостойкости изделия подвергают термической обработке с последующим травлением плавиковой кислотой. Изделия с острыми гранями и выступами имеют меньшую термостойкость.
Стекло значительно лучше сопротивляется быстрому нагреву, чем резкому охлаждению. Это объясняется тем, что при быстром охлаждении в поверхностных слоях возникают большие растягивающие напряжения, а во внутренних, еще более нагретых, напряжения сжатия. Чем больше перепад температур при охлаждении, тем выше эти напряжения. Возникающие в наружных слоях напряжения растяжения не могут противостоять более высоким напряжениям сжатия внутренних слоев, и стекло быстро разрушается.
При быстром нагревании в поверхностных слоях стекла возникают напряжения сжатия, во внутренних – напряжения растяжения. В данном случае напряжения сжатия легко противостоят меньшим напряжениям растяжения внутренних слоев, поэтому изделия не разрушаются. Таким образом, термостойкость стекла при быстром нагревании выше, чем при быстром охлаждении.
Оптические свойства стекла – преломление, поглощение, отражение и светопропускание падающего на него светового потока.
Преломление. При переходе луча света из одной среды в другую меняется его направление. Показатель преломления зависит от среды, длины волны падающего света и температуры. С повышением температуры он возрастает. В пределах температуры размягчения он изменяется в зависимости от структурных превращений в стекле. Показатель преломления во многом зависит от химического состава, по его величине можно судить о природе стекла. Для натриево-кальциево-силикатных стекол он колеблется в пределах от 1,48 до 1,52, а для хрустального – от 1,65 до 1,9. Показатель преломления повышается при введении в состав стекла PbO, B2O3, TiO2 и WO3 и понижается при увеличении содержания кремнезема и оксида алюминия. Игра света, характерная для изделий из хрустального стекла, объясняется высоким показателем преломления. Для лучшего выявления этой особенности хрустальные изделия изготовляют более толстостенными и украшают глубокими алмазными гранями.
Поглощение света стеклом является существенным его недостатком. Оконное стекло поглощает до 2 % проходящего через него светового потока, и прежде всего его ультрафиолетовую часть, наиболее важную для жизнедеятельности организма. Наибольшим светопропусканием, в том числе и ультрафиолетовых лучей, обладают кварцевое стекло, плавленый борный ангидрид и увиолевые стекла.
Увиолевые стекла изготовляют из сырья без примесей окрашивающих оксидов Fe2O3 и TiO2, в их состав входят также SiO2, В2О3, ВаО, СаО и др.
Повышенное содержание оксидов железа (II) и (III) придает стеклу зеленовато-желтоватый оттенок, что резко снижает светопропускание. Оконное стекло, пропускающее менее 84 % падающего светового потока, нельзя использовать для остекления жилых помещений.
Для получения стекол непрозрачных для ультрафиолетовой части спектра на поверхность стекол наносят пленку оксида железа или вводят в их состав до 3,5 % Fe2О3. Такие стекла применяют в районах с жарким климатом – они задерживают 50 % и более солнечной радиации.
Солнцезащитные стекла получают следующим способом. На поверхность стекла, находящегося в состоянии, близком к размягчению, наносят оксидно-металлические покрытия из пленкообразующих растворов. Такие пленки чаще всего бывают на основе хлоридов олова и сурьмы, олова, кобальта и др.
Отражение света стеклом зависит от его природы и характера поверхности. Больший световой поток отражается от ровной блестящей поверхности и меньший – от матовой; это свойство стекла используют для нанесения на изделия рисунка – матовой ленты.
Отношение отраженного света к падающему световому потоку, выраженное в процентах, называется коэффициентом отражения R. Чем больше угол падения, тем больше коэффициент отражения. Для снижения коэффициента отражения и повышения светосилы поверхность изделия покрывают тонкой пленкой с меньшим показателем преломления. Этот метод называется просветлением, он позволяет сократить коэффициент отражения стекла с 4-6 до 0,7-0,3 %. Если коэффициент преломления этой пленки больше, чем стекла, то коэффициент отражения поверхности увеличивается. Нанесение слоев из различных оксидов используют в стеклоделии с декоративной целью – для придания эффекта ирризации и получения люстровых слоев с повышенным коэффициентом отражения.
Основными электрическими свойствами стекла являются электропроводность, электрическая проницаемость и электрическая прочность.
Электропроводность стекла характеризуется его удельным сопротивлением прохождению электрического тока и выражается в Ом·см. Стекло – плохой проводник электричества, оно относится к изоляторам. При повышенной температуре и высоком напряжении электропроводность стекла возрастает.
Стекла обладают ионной проводимостью. Наибольшей способностью к передвижению под влиянием электрического тока обладают ионы натрия и калия, потому что их связи не так прочны, как двухвалентных ионов. Наиболее сильно влияют на электропроводность щелочные оксиды; борный ангидрид и кремнезем снижают ее. Лучшим диэлектриком является чистый кварц, удельное сопротивление которого равно 1018 Ом·см.
Электрическая проницаемость стекла зависит от его состава. Она тем выше, чем больше в стекле щелочных оксидов. С увеличением содержания в стекле ВаО и РbО она особенно возрастает. Диэлектрическая проницаемость стекла выше, чем кристаллического тела.
Электрическая прочность стекла характеризуется отношением разности между потенциалами, при которой происходит пробой диэлектрика, к его толщине и выражается в В/м. Прочность плавленого кварца возрастает при повышенном содержании кремнезема и щелочно-земельных оксидов и снижается с увеличением содержания щелочных оксидов. Оксиды, повышающие удельное сопротивление стекла прохождению электрического тока, аналогично воздействуют и на его электрическую прочность.
Тема 3. Основы производства стеклянных изделий
Производство стеклянных изделий состоит в основном из трех этапов: получения стекломассы, формования изделий и обработки изделий. Каждый из этих этапов включает ряд операций, обеспечивающих получение изделий с определенными свойствами с учетом их назначения. Процесс изготовления стеклоизделий строится по заранее разработанному режиму. Нарушение установленных режимов может привести к ухудшению качества готовой продукции или к браку.
Получение стекломассы.
Сырьевые материалы делят на главные, или стеклообразующие, и вспомогательные.
К главным, стеклообразующим, материалам относятся вещества, необходимые для введения в стекломассу кислотных, щелочных и щелочноземельных оксидов, обеспечивающих получение изделий с необходимыми физическими и химическими свойствами.
Вспомогательные материалы применяют для придания готовым изделиям цвета, обеспечения необходимых условий для получения изделий высокого качества, а также ускорения процессов варки и осветления стекломассы. В некоторых случаях одни и те же материалы могут выполнять различные функции.
Главные материалы. К ним относятся кварцевый песок, борная кислота или бура, полевой шпат, каолин, сода и сульфат натрия, поташ, известняк и мел, доломит, сурик, оксиды цинка, алюминия, кальция, магния и бария, нефелин, стекольный бой и другие соединения.
Кварцевый песок является основным сырьем для введения в состав стекла кремнезема, которого в нем содержится от 60 до 75 %. Кремнезем является важнейшей составной частью промышленных стекол. От содержания SiCb зависят свойства стекла, например повышается химическая стойкость, снижается хрупкость. Он встречается в природе в аморфной и кристаллической формах, температура плавления его 1713 °С, плотность – 2,65 г/см!. Песок относится к породам осадочного происхождения, образуется при разрушении полевошпатовых горных пород под действием атмосферных агентов (воды, воздуха, смены температур).
Высококачественные пески должны содержать кремнезема не менее 99 %. Лучшим является песок без примесей окрашивающих оксидов, в том числе оксидов железа, титана, хрома. Наиболее вредные примеси – соединения железа, которые придают стеклу желтовато-зеленоватую окраску, что резко снижает пропускание ультрафиолетовых лучей, ухудшает внешний вид готовых изделий. При получении бытовых стеклянных изделий содержание примесей железа в песке может быть не более 0,03 %, а хрустальных – до 0,012 %. Строго ограничивается также содержание диоксида титана (от 0,01 до 0,2 % ) и оксида хрома (III) (от 0,05 до 0,1 %).
Для оценки пригодности песка очень важна однородность его зерен, а также степень дисперсности. Одинаковые по размеру зерна песка равномерно расплавляются при варке, при этом исключается образование в стекломассе дефекта, называемого «материальным камнем» (нерасплавившиеся крупные зерна). Пылевидные частицы (менее 0,012 мм) способствуют появлению дефекта «мошка».
Борную кислоту или буру применяют для введения в стекло борного ангидрида – В2О3. При высокой температуре борная кислота разлагается с образованием борного ангидрида и воды, а бура – борного ангидрида и оксида натрия.
Борный ангидрид плавится при температуре 600 °С, при охлаждении превращается в прозрачную стекловидную массу. Он понижает коэффициент расширения, температуру варки и вязкость стекломассы, повышает показатель преломления, химическую и термическую устойчивость и прочность. Применяют его при получении высококачественных или специальных изделий, изготовляемых механизированным способом.
Для введения оксида бора в состав стекла используют также природные минералы – ашарит, тинкал и др.
При введении 1-1,5% борного ангидрида производительность при варке стекломассы повышается на 15-20 %.
Полевой шпат – исходное сырье для введения в состав стекол глинозема – Аl2О3. Для этой цели используют также каолин (Al2O3∙2SiO2∙2H2O), являющийся продуктом разложения полевого шпата, пегматит, сиенит, обсидиан, чистый глинозем и другие вещества. Нефелиновые сиениты – чрезвычайно ценное сырье, так как, кроме глинозема, они содержат около 20 % щелочей, что позволяет экономить более дорогостоящие соду и поташ. Глинозем имеет плотность 3,85 г/см3 и температуру плавления 2050 °С.
Глинозем замедляет скорость варки, но способствует осветлению стекломассы (при малом содержании щелочей), повышает термическую и химическую стойкость, механическую прочность и твердость, снижает коэффициент термического расширения стекла. При получении натриево-кальциевых стекол введение глинозема за счет кремнезема, а также оксиды натрия и калия повышает вязкость стекломассы. Используют глинозем при изготовлении сортовой, жароупорной и химической посуды, оконного и бутылочного стекол.
Сода служит для введения в состав стекла оксида натрия – Na2O. Получают ее обезвоживанием кальцинированной соды. Плавится она при температуре 855 °С. Недостатком соды является большое содержание вредных примесей хлорида и сульфата натрия, оксида железа. В стекольной промышленности чаще применяют сульфат натрия в виде мирабилита (Na2SO4∙ 1OH2O). Температура плавления его 884 °С. Сульфат натрия более дешевое и менее дефицитное сырье по сравнению с содой.
Поташ – основное вещество для введения в состав стекла оксида калия. Он бывает кристаллический и кальцинированный. В стекловарении применяют в основном кальцинированный поташ с температурой плавления 88 °С. Оксид калия придает изделиям блеск, прозрачность, уменьшает вероятность кристаллизации. В основном его применяют для изготовления высококачественной посуды, хрустальных и цветных изделий, оптических стекол.
Известняк и мел применяют для введения оксида кальция, которая придает стеклу химическую устойчивость и способствует осветлению и ускорению варки стекломассы. Известняк представляет собой осадочную породу, мел – разновидность кальцита, мягкая и рыхлая порода. При температуре свыше 600 °С известняк разлагается с выделением оксида кальция. Вредной примесью является оксид железа, которой допускается не более 0,03 %.
Доломит – двойная соль угольной кислоты, разлагается при нагревании с выделением оксидов кальция и магния. Оксид магния снижает термическое расширение стекла и способность к кристаллизации, а также повышает вязкость, прочность и химическую устойчивость.
Цинковые белила служат для введения в стекло оксида цинка. При варке они полностью переходят в стекло. Оксид цинка повышает химическую и термическую стойкость стекла, а также прочность при сжатии и растяжении. Изделия, содержащие оксид цинка, сильно преломляют лучи света, отличаются повышенным блеском и прозрачностью. Широко применяют ZnO при производстве лабораторного, технического и некоторых других специальных видов стекла.
Для получения цинкосульфидного стекла используют сульфиды цинка, которые при определенной температуре вызывают помутнение стекла. Чем медленнее охлаждение, тем больше помутнение. Оно также зависит от соотношения оксидов кальция и цинка. Так, при увеличении содержания СаО и уменьшении ZnO скорость глушения замедляется, а стекло темнеет.
Сурик используют в производстве ценных хрустальных изделий и оптического стекла с высокой плотностью, характерным блеском и игрой света. Сурик разлагается при температуре 880 °С с выделением атомарного кислорода, что облегчает осветление стекломассы. Изделия, содержащие оксид свинца, легко поддаются гранению, шлифовке, полировке и др. Они сильно преломляют лучи света, имеют пониженную химическую устойчивость, поглощают рентгеновские лучи. Особенностью хрустальных изделий является чистый мелодичный и продолжительный звук при постукивании деревянной палочкой. Недостаток свинцового хрусталя – высокая чувствительность к окислительно-восстановительным условиям варки. Этого недостатка не имеет бариевый хрусталь, практически не отличающийся по свойствам от свинцового хрусталя.
Для введения в стекломассу оксида бария служит карбонат бария в виде минерала витерита, имеющего высокую плотность (4,2-4,3 г/см3).
В последние годы в стекловарении начали применять и другие оксиды, в том числе и четырехвалентных редких элементов: оксид германия, диоксид титана, диоксид циркония, оксид тория и т. д. Оксид германия повышает показатель преломления, диоксид титана, кроме того, – химическую устойчивость и поглощает ультрафиолетовую часть спектра. Диоксид циркония способствует повышению химической и термической стойкости (снижает коэффициент термического расширения), прочности при сжатии и растяжении и снижает хрупкость.
Кроме указанных веществ, применяют материалы, содержащие одновременно несколько стеклообразующих оксидов. К ним относятся в основном горные породы – нефелин, трахит, пепел и др.
Стекольный бой способствует ускорению варки стекломассы. В состав шихты его вводят от 15 до 30 %. Химический состав стекольного боя должен соответствовать химическому составу основной шихты. Не допускается смешивание боя стекол различных составов, так как это ведет к изменению режимов процесса варки стекломассы и формования изделий.
Вспомогательные материалы. Основными вспомогательными материалами являются красители, глушители, обесцвечиватели, осветлители, окислители, восстановители и ускорители варки стекломассы.
Глушители вводят в шихту для придания стеклу молочно-белого цвета, а также устранения его прозрачности и обеспечения высокой рассеивающей способности. Такие стекла называют глушеными. В качестве глушителей применяют вещества, которые в процессе варки стекломассы или не растворяются в ней, или растворяются, а при охлаждении выделяются из расплава в виде мелких кристаллов. Коэффициент светопреломления их резко отличается от этого коэффициента других компонентов шихты. Для получения глушеных стекол применяют фосфаты кальция, костяную муку, кремнефтористый натрий, криолит, оксид олова, тальк и др. Глушеные стекла имеют малый коэффициент светопропускания: молочные – не менее 0,5, опаловые – не менее 0,6.
Обесцвечиватели устраняют либо ослабляют ненужный цвет или оттенок, который придает стеклу прежде всего оксид железа (II). Различают обесцвечивание химическое и физическое.
При химическом обесцвечивании в шихту вводят вещества, выделяющие при разложении большое количество атомарного кислорода, который способствует переводу оксида железа (II) в оксид железа (III). При этом интенсивность окраски снижается в десятки раз. Для химического обесцвечивания применяют селитру, As2O3, диоксид церия и др.
Физическое обесцвечивание заключается в подборе красителя, нейтрализующего окраску стекла оксидом железа (II). К таким обесцвечивателям относятся пероксид марганца, селен, оксид никеля, оксид кобальта, оксид неодима и др.
Эффективность обесцвечивания зависит от соотношения содержания оксидов железа (II) и (III), химического состава, температуры и среды при варке стекломассы. При химическом обесцвечивании среда в печи должна быть окислительной.
Осветлители вводят в шихту для освобождения стекломассы от различных включений газа и воздуха, а также для окисления оксида железа (II) до оксида железа (III). К ним относятся вещества, которые при разложении выделяют большое количество газа, способствующего перемешиванию стекломассы и объединению мелких разрозненных пузырьков в крупные (крупные включения значительно легче выделяются из стекломассы). Для осветления применяют As2O3, селитру, сульфат натрия, аммонийные соли, иногда сырую древесину и другие паро- и газообразующие вещества. Для улучшения осветления повышают температуру варки стекломассы (при этом понижается вязкость). Применяют также осветлитель, плотность которого выше плотности основной стекломассы. При этом осветлитель погружают на дно печи и образующиеся при его разложении газы, проходя через стекломассу, перемешивают ее, что способствует удалению газовых и воздушных включений.
Окислители и восстановители используют для создания и поддержания соответствующей среды при варке стекломассы, для окисления оксида железа (II). Чаще всего применяют натриевую и калиевую селитру, As2O3. Калиевая селитра, разлагаясь при более высокой температуре, дает большой эффект. Эффективно также совместное применение As2O3 и селитры, при этом As2O3 переходит в As2O5, который является окислителем ряда красителей.
К восстановителям относятся углерод, применяемый в виде кокса и древесного угля, SnO, SnCl2 и др.
Для ускорения и снижения температуры варки стекломассы в состав шихты вводят фторид кальция, кремнефтористый натрий, а также борный ангидрид и нитраты калия и натрия с оксидом алюминия.
Подготовка сырьевых материалов. Для получения качественной стекломассы и изделий сырьевые материалы подвергают соответствующей подготовке. В зависимости от природы и вида исходного вещества она включает такие операции, как обогащение, сушка, измельчение и др.
Песок подвергают обогащению, т. е. освобождению от различных загрязнений и примесей оксидов железа. Для этого применяют физические и химические способы – магнитную и электросепарацию, отмучивание, промывку, флотацию, флотооттирку и обработку различными реагентами. Химическое и физическое обогащение основано на различии физических свойств основного сырья и посторонних примесей, а также на разном отношении их поверхности к смачиванию и химическим реагентам. После обогащения песок тщательно промывают для освобождения от посторонних и глинистых примесей и сушат.
Каменистые материалы (известняк, мел, доломит и др.) подвергают дроблению и помолу. Дробление производят на щековых дробилках и бегунах, а тонкий помол – в мельницах различного типа. Просеивают исходные материалы на специальных ситах с электромагнитами, что обеспечивает окончательное удаление металлических, в том числе и железистых, включений.
Красители, обесцвечиватели и другие вспомогательные материалы вводят в состав стекломассы в небольших количествах. Для равномерного распределения в общей массе их подвергают более тонкому помолу и просеивают через сито (от 4900 до 6400 отверстий на 1 см2).
Стекольный бой сортируют по химическому составу и величине кусков, промывают водой для удаления загрязнений, измельчают, пропускают через электромагнит.
Подготовленные соответствующим образом сырьевые материалы взвешивают на автоматических весах по определенной рецептуре и тщательно перемешивают для получения однородной по составу порошкообразной смеси – шихты. При определении состава шихты необходимо учитывать примеси, содержащиеся в исходных материалах, а также потери и отходы, которые могут произойти при варке.
Варка стекломассы. Процесс варки стекломассы представляет комплекс физических, химических и физико-химических процессов, происходящих в шихте, расплаве силикатов и стекломассе. Физическими процессами являются нагревание шихты, испарение влаги, улетучивание и плавление компонентов; химическими – расщепление гидратов, удаление химически связанной воды, разложение карбонатов и других веществ. К физико-химическим процессам, протекающим при варке стекломассы, относятся взаимное растворение исходных веществ в твердом и жидком состояниях, взаимодействие газов атмосферы печи со стекломассой и др.
Весь процесс варки стекломассы можно разделить на следующие основные этапы: силикатообразование, стеклообразование, осветление, гомогенизация и охлаждение стекломассы до рабочей вязкости (студка). Каждый этап характеризуется специфическими процессами и для получения качественной стекломассы должен быть проведен при соблюдении определенных условий.
Силикатообразование. На этом этапе после удаления гигроскопической воды (при температуре 100-120 °С) при дальнейшем нагревании образуется двойной натриево-кальциевый карбонат в твердом состоянии. При температуре 600 °С начинается выделение углекислого газа. При нагревании до 830 °С двойной карбонат взаимодействует с кремнеземом с выделением углекислого газа. При температуре 740-800 °С появляется расплав, более активно взаимодействующий с кремнеземом. Двойной карбонат диссоциирует на свободные оксиды кальция и натрия. Оксид кальция взаимодействует с кремнеземом с образованием метасиликата (CaO∙SiO2). Шихта при этом превращается в спекшуюся массу силикатов и кремнезема, содержащую много газовых включений. Заканчивается период при температуре около 1000 °С.
Стеклообразование. По мере повышения температуры происходит дальнейшее растворение зерен песка и силикатов в расплаве. Стекломасса становится более прозрачной и подвижной, но в ней еще много газовых и твердых включений. Стеклообразование протекает при температуре 1150-1500 °С и отличается от силикатообразования большей интенсивностью диффузионных процессов.
Осветление. На этом этапе происходит освобождение стекломассы от газовых и воздушных включений. Он является наиболее сложным и важным для получения качественной стекломассы. Осветление проводят при температуре 1450-1500 °С, при этом вязкость стекломассы понижается, что способствует более легкому удалению из нее пузырей. В атмосфере печи снижается парциальное давление; оно должно быть меньше, чем в стекломассе. При варке свинцовых и цветных стекол в печи создается окислительная среда. Осветлению способствуют также газы, выделяющиеся при разложении осветлителей: они перемешивают стекломассу, что облегчает образование более крупных пузырьков, которые легче удаляются. Кроме того, стекломассу перемешивают путем погружения в нее сырой древесины, при сгорании которой выделяется углекислый газ, или сжатым воздухом – барботированием. В результате осветления стекломасса становится прозрачной и однородной.
Гомогенизация. Ее проводят при максимальной температуре варки одновременно с осветлением стекломассы. При этом стекломасса выдерживается в спокойном состоянии, выравнивается по химическому составу и освобождается от стекловидных нитеводных включений – свилей.
Охлаждение. Стекломассу охлаждают до вязкости, при которой из нее можно формовать изделия. На этом этапе температура в печи снижается на 200-300 °С.
Основными факторами, ускоряющими варку стекломассы и влияющими на показатель ее качества, являются температура, поверхность нагрева шихты (чем она больше, тем лучше) и степень дисперсности зерен песка.
Лучший провар стекла достигается при удельной поверхности песка до 2000 см2/г, при дальнейшем увеличении ее скорость провара снижается. Варка стекломассы при повышенной температуре (1540-1590 °С) позволяет увеличить производительность печи на 10 %. С повышением температуры на 10 °С производительность печи возрастает на 4-5 %.
Нарушение установленных требований при подготовке сырьевых материалов, а также режимов варки стекломассы может привести к появлению некоторых дефектов в стекле.
Формование изделий. Из стекломассы с необходимой вязкостью и поверхностным натяжением, освобожденной от газовых, воздушных и других включений, формуют изделия. В зависимости от вида, размера, массы, назначения, сложности формы и химического состава изделия формуют ручным или машинным способом. Ручным способом изготовляют изделия сложной формы и высокохудожественные. Изделия простой формы, в том числе некоторые предметы.стеклянной бытовой посуды, вырабатывают на высокопроизводительных автоматах и полуавтоматах. Применяют следующие способы формования изделий: прессование, выдувание, прессовыдувание, вытягивание, прокатка, литье, а также комбинированный метод сочленения, центробежного вращения и плавающей ленты. Для придания однотипным изделиям стабильной формы используют чугунные или стальные пресс-формы, внутренние поверхности которых покрывают нержавеющими жароупорными сплавами.
Прессование изделий производят в специальных пресс-формах, внутренняя поверхность которых может быть с рельефным рисунком или гладкой. Рельефный рисунок на поверхности пресс-формы полностью воспроизводится в виде выпуклого рисунка на наружной поверхности изделия.
Выдувание применяют для изготовления разнообразных изделий сложной формы, чаще всего полых. Оно бывает как ручным (свободным), так и механизированным (в формы).
Способ сочленения является комбинированным: элементы изделия формуют отдельно, а затем сочленяют в горячем состоянии. Этот метод более производителен, но часто изделия разрушаются по месту сочленения.
Метод литья применяют для получения изделий художественно-декоративного назначения, скульптуры и оптического стекла. Стекломассу заливают в специальную форму, где она охлаждается и принимает очертания формы. Этим методом вырабатывают изделия полнотелые и пустотелые.
Методом центробежного вращения изготовляют полые, крупногабаритные и тяжелые изделия. В металлическую форму определенного размера, установленную на вращающемся столе, помещают стекломассу. Форма вращается, и стекломасса под действием центробежной силы равномерно распределяется по стенкам формы, излишек ее срезают ножницами и удаляют. После формования пресс-форму раскрывают, изделие извлекают и подвергают соответствующей обработке.
Метод вытягивания и прокатки применяют для получения листового стекла.
После формования изделия для придания им соответствующего вида и необходимых свойств подвергают дальнейшей тепловой, химической или механической обработке. К такой обработке относят отжиг, отрезку колпачка (у выдувных изделий), обработку края (шлифовку, огневое оплавление) и др. Этой обработке подвергают чаще всего выдувные стеклянные изделия.
Отжиг. При формовании между внутренними и поверхностными слоями стеклоизделий вследствие быстрого и неравномерного охлаждения наблюдается значительный перепад температур. При этом в толще стекла возникают термоупругие напряжения, которые тем выше, чем ниже его теплопроводность. Эти термомеханические напряжения отрицательно влияют на прочность стеклянных изделий – она резко снижается, что иногда приводит к растрескиванию изделий сразу же после остывания или при эксплуатации.
Отжиг состоит в нагреве изделий до температуры начала размягчения (530-580 °С), при которой наблюдается высокая подвижность частиц, выдержке при этой температуре и медленном охлаждении. При отжиге полностью или частично устраняются внутренние напряжения и тем быстрее, чем выше температура отжига и ниже вязкость стекла. Однако температура отжига не должна вызывать деформацию изделий.
Обработка изделий включает такие операции, как отделение колпачка, отопка или шлифовка края, полировка и декорирование изделий.
При полировке механическим способом изделие обрабатывают специальными кругами или щетками. В качестве полирующего состава применяют тонкодисперсную пемзу или оловянный порошок.
При химическом полировании изделия обрабатывают смесью плавиковой и серной кислот. Химическое полирование дает хорошие результаты при обработке хрустальных изделий. В настоящее время применяют и плазменную полировку, после которой поверхность не отличается по оптическим характеристикам от поверхности изделия, полученного выдуванием.
Демонстрационные опыты:
Опыт 3. Изготовление стекла.
В фарфоровый тигель помещаем измельченную шихту состава: 70% SiO2, 10% CaCO3, 10% Na2CO3 и 10% стекольного боя. Нагреваем в муфельной печи до температуры 1150˚С в течение 30 мин. После охлаждения изучаем образовавшуюся стекломассу.
Тема 4. Окрашивание стекла
Для окрашивания стекла используют красители различной природы. В процессе варки стекломассы они либо растворяются и образуют с кремнеземом окрашенные силикаты, либо сохраняются в виде коллоидно-дисперсных частиц, обеспечивая избирательное поглощение стеклом тех или иных лучей света. Первые красители называются молекулярными, вторые – коллоидно-дисперсными. Интенсивность окраски зависит от концентрации красящих веществ, толщины стенок изделий, продолжительности и температуры варки стекломассы.
К молекулярным красителям (их большинство) относятся, как правило, оксиды тяжелых и редкоземельных металлов (Со, Ni, Мn, Сu, Сr). Они придают стеклу определенный цвет без дополнительной тепловой обработки. Цвет стекла зависит от характера и количества красящего оксида, химического состава стекломассы, среды и условий варки.
Оксид кобальта при малом содержании (0,1-0,5 %) придает стеклу синий цвет, при большем – фиолетово-синий с красноватым оттенком. При совместном введении соединений кобальта и пероксида марганца получают стекла пурпурного, фиолетового и черного цветов. Окраска калиевых стекол интенсивнее, чем натриевых. Оксид марганца окрашивает натриево-кальциевые стекла в красновато-фиолетовый цвет. При добавлении перекиси марганца и хромпика получают черные стекла. Оксид марганца придает стеклу фиолетовый цвет.
Оксид никеля окрашивает калиево-кальциевые стекла в красновато-фиолетовый цвет, а натриево-кальциевые – в фиолетовый с коричневатым оттенком.
Оксид меди придает стеклу голубой (при содержании 1-2 %) или зеленый цвет, а оксид хрома – зеленый.
Желтый цвет может быть получен при введении в стекломассу сульфида кадмия, сульфида, оксида урана.
Комбинируя различные красители, получают стекла разнообразных цветов и оттенков. При смешивании желтых и красных красителей получают стекло оранжевого и коричневого цветов. Оксид железа окрашивает стекло в сине-зеленый цвет, оксид железа – в желтый, а при совместном введении оксидов железа (II) и железа (III) получают стекло зеленого цвета. Белый цвет стеклу придают диоксид олова и криолит; черный – оксид марганца (в количестве 12-13 %) и сульфиды железа.
Коллоидно-дисперсные красители придают стеклу цвет после тепловой обработки (наводки). Интенсивность окраски зависит от величины и количества частиц красителя, которые выделяются при наводке. К числу таких красителей относятся золото, серебро, медь, селен, сурьма, а также сульфиды свинца, железа, меди, кадмия и селена и др. Их используют для получения рубиново-красного стекла. Золотой рубин, например, получают при добавлении в стекломассу 0,02 % хлорного золота и диоксида олова; при повторной тепловой обработке кристаллы золота увеличиваются и придают стеклу красный (размер кристаллов 10-13 мкм), розовый (5-10мкм) или бурый (более 13мкм) цвет. Серебро, введенное в шихту в виде AgNO3, окрашивает стекло в желтый цвет.
Таким способом получают медный рубин, авантюрин и сульфидные стекла, содержащие соединения серы, которые способны образовывать широкую гамму цветов – от светло-янтарного до черного.
В последнее время начали широко использовать сульфиды цинка. Реакция окрашивания сульфидно-цинковых стекол может быть представлена уравнением реакции:
FeO + ZnS = ZnO + FeS
При этом каждый компонент является активным красителем или глушителем. Изменяя соотношение компонентов, можно получать сульфидно-цинковые стекла от прозрачных до полностью заглушённых, от светло-зеленых, серых, сиреневых, бирюзовых, голубых оттенков до почти черных тонов.
Соотношение красящих веществ зависит от состава шихты, режима времени, температуры и восстановительного характера среды варки стекломассы, что и обусловливает разнообразную палитру сульфидно-цинковых стекол и изделий из них. Серу и цинк вводят в шихту путем добавления от 1 до 4 % сульфида цинка и 1-1,5 % каменного угля с содержанием серы 1-4 %, а железо является непременной примесью кварцевого песка. Сернистые соединения цинка образуют микроскопические частицы, придающие стеклу соответствующий оттенок
Не нашли, что искали? Воспользуйтесь поиском: