
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Электродные потенциалы. Направление ОВР
В каждой окислительно-восстановительной реакции, в том числе в реакции
Zn + CuSO4 → ZnSO4 + Cu
Участвуют две окислительно-восстановительные пары - восстановитель (Zn) и его окисленная форма (Zn2+); окислитель (Cu2+) и его восстановленная форма (Cu).
Мерой окислительно-восстановительной способности данной пары является окислительно-восстановительный или электродный потенциал, который обозначают EOx/Red, где Ох – окисленная форма, Red – восстановленная форма (например, EZn2+/Zn, ECu2+/Cu). Измерить абсолютное значение потенциала невозможно, поэтому измерения осуществляют относительно эталона, например, стандартного водородного электрода.
Стандартный водородный электрод состоит из платиновой пластинки, покрытой тонким порошком платины, погружённой в раствор серной кислоты с концентрацией ионов водорода, равной 1 моль/л. Электрод омывают током газообразного водорода под давлением 1.013·105 Па при температуре 298 К. На поверхности платины протекает обратимая реакция, которую можно представить в виде:
2Н+ + 2ē = Н2
Потенциал такого электрода принимают за нуль:
Е02Н+/Н2 = 0 В (размерность потенциала – вольт).
Стандартные потенциалы измерены или рассчитаны для большого числа окислительно-восстановительных пар (полуреакций) и приведены в таблицах. Например,
E0Zn2+/Zn = -0.76 В, E0Cu2+/Cu = 0.34 В. Чем больше значение EOx/Red, тем более сильным окислителем является окислительная форма (Ох) данной пары. Чем меньше значение потенциала – тем более сильным восстановителем является восстановленная форма (Red) окислительно-восстановительной пары.
Ряд металлов расположенных в порядке увеличения их стандартных электродных потенциалов, называют электрохимическим рядом напряжений металлов (рядом активности металлов):
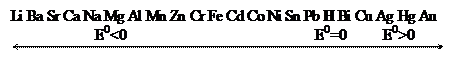
Начинается ряд наиболее активными металлами (щелочными), а завершается «благородными», т.е. трудноокисляемыми металлами. Чем левее расположены в ряду металлы, тем более сильными восстановительными свойствами они обладают, они могут вытеснять из растворов солей металлы, стоящие правее. Металлы, расположенные до водорода, вытесняют его из растворов кислот (кроме HNO3 и H2SO4 конц ).
В тех случаях, когда система находится в нестандартных условиях, значение электродного потенциала можно рассчитать по уравнению Нернста:
| EOx/Red = E0Ox/Red + | 2.3·R·T | · lg | [Ox]A | , (37) |
| n·F | [Red]B |
где, EOx/Red – потенциал системы при нестандартных условиях, В;
E0Ox/Red – потенциал системы при стандартных условиях, В;
R – универсальная газовая постоянная (8.31 Дж/моль·К);
Т – температура, К;
n – число электронов, участвующих в процессе;
F – число Фарадея (96500 К/Моль);
[Ox]A, [Red]B – произведение концентраций (моль/л) окисленной и восстановленной форм участников процесса, возведенных в степень стехиометрических коэффициентов.
Концентрации твердых веществ и воды принимают за единицу.
При температуре 298 К, после подстановки численных значений R и F, уравнение Нернста принимает вид:
| EOx/Red = E0Ox/Red + | 0.059 | · lg | [Ox]A | , (38) |
| n | [Red]B |
Так для полуреакции
MnO4- + 8H+ + 5ē→Mn2+ + 4H2O
Уравнение Нернста
| E MnO4-/Mn2+ = E0MnO4-/Mn2+ + | 0.059 | · lg | [MnO4-]·[H+]8 |
| [Mn2+] |
Используя значения электродных потенциалов, можно определить направление самопроизвольного протекания окислительно-восстановительной реакции. В ходе ОВР электроны всегда перемещаются от пары, содержащей восстановитель, к паре, содержащей окислитель. Обозначим EOx – электродный потенциал пары, содержащей окислитель; ERed - электродный потенциал пары, содержащей восстановитель.
Если EOx > ERed - самопроизвольно может идти прямая реакция; если EOx < ERed – прямая реакция невозможна, но возможна обратная реакция.
Для рассмотренной ранее реакции
E0Ox = E0Cu2+/Cu = 0.34 B, E0Red = E0Zn2+/Zn = -0.76 B, EOx > ERed, то есть реакция в стандартных условиях возможна.
Не нашли, что искали? Воспользуйтесь поиском: