
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Химические источники тока
Химические источники тока (ХИТ) – это системы для непосредственного превращения химической энергии окислительно-восстановительной реакции в электрическую. В настоящее время существует очень большое число типов ХИТ: гальванические, комбинированные, резервные, топливные элементы, аккумуляторы. Основной окислительной особенностью аккумуляторов является то, что реакции, протекающие в них, являются обратимыми, поэтому их можно заряжать и использовать ни один раз. Условное обозначение ХИТ:
(а)/ электролит // электролит/ (к)
или (а)/электролит/(к),
где (а)- материал анода (электрода, на котором идёт процесс окисления);
(к)- материал катода (электрода, на котором идёт процесс восстановления);
/- поверхность раздела электролит- раствор или расплав электролита;
//- Поверхности раздела пространственно удалены друг от друга. При работе источников тока в них протекают достаточно сложные, многостадийные процессы. Условия, необходимые для получения электрического тока в ХИТ:
· ХИТ должен содержать два электрода с различными потенциалами;
· Процессы окисления и восстановления должны быть пространственно разделены;
· Внешняя и внутренняя цепь должны быть замкнуты.
Далее будут рассмотрены примеры только гальванических элементов.
Пример1. Схема гальванического элемента:
Zn / ZnSO4 // H2SO4 / H2 (Pt).
Слева – цинковый электрод, погруженный в раствор сульфата цинка, справа – стандартный водородный электрод (платиновая пластина в растворе серной кислоты). Условия работы гальванического элемента будем считать стандартными, т.е. потенциал электрода из цинка E0Zn2+/Zn = -0.76 В,
потенциал водородного (платинового) электрода Е0Н+/Н2 = 0 В.
Условие самопроизвольного протекания окислительно-восстановительной реакции – EOx > ERed, следовательно, на правом электроде будет идти полуреакция восстановления (платина – катод), а на левом – окисления (цинк – анод):
· Анодный процесс - Zn – 2ē → Zn2+;
· Катодный процесс - 2Н+ + 2ē → Н2.
Ионное и молекулярное уравнение реакции, на которой основана работа гальванического элемента:
Zn + 2H+ → Zn2+ + H2; Zn + H2SO4 → ZnSO4 + H2.
 Электроны, отдаваемые цинком, по внешней цепи перемещаются к катоду, а в противоположном направлении, по внутренней цепи, перемещаются отрицательно заряженные ионы SO42-:
Электроны, отдаваемые цинком, по внешней цепи перемещаются к катоду, а в противоположном направлении, по внутренней цепи, перемещаются отрицательно заряженные ионы SO42-:
ЭДС любого ХИТ рассчитывается как разность
Екатода - Еанода= 0 - (-0.76) = 0.76 В. Значение ЭДС должно быть больше нуля.
Пример 2. Схема гальванического элемента:
Al / Al2(SO4)3 0.005 М // KClO3; KCl; H2SO4 / (C).
Слева – алюминиевый электрод, погруженный в раствор сульфата алюминия с концентрацией 0.005 моль/л (при обозначении молярной концентрации обозначение размерности моль/л часто заменяют буквой М), справа – графитовый электрод в растворе двух солей при стандартных условиях. Потенциал алюминиевого электрода необходимо рассчитать по уравнению (37):
| ЕAl3+/Al = Е0Al3+/Al + | 0.053 | ·lg[Al3+] |
В условиях указана концентрация соли, ионы алюминия образуются при ее диссоциации:
Al2(SO4)3 → 2Al3+ + 3SO42-,
поэтому [Al3+] = 2 · 0.005 = 0.01 M.
Таким образом,
| ЕAl3+/Al = -1.66 + | 0.053 | ·lg0.01 = -1.66 – 0.04 = -1.70 |
Потенциал графитового электрода равен стандартному потенциалу окислительно-восстановительной пары ClO3-/Cl-:
Е0ClO3-/Cl- = 1,45 В
Е0ClO3-/Cl- > Е0Al3+/Al, т.е в левом полуэлементе находится восстановитель (идет полуреакция окисления, алюминий – анод):
| Анодный процесс | Al – 3ē → Al3+ | |
| Катодный процесс | ClO3- + 6Н+ + 6ē → Cl- + Н2О |
Ионное и молекулярное уравнение реакции:
2Al + ClO3- + 6Н+ → 2Al3+ + Cl- + 3Н2О
2Al + KClO3 +3H2SO4 → Al2(SO4)3 + KCl + Н2О
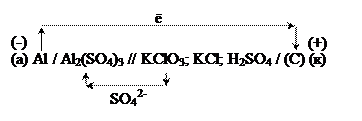 Условная схема работы гальванического элемента:
Условная схема работы гальванического элемента:
ЭДС = 1.45 В – (-1.70) = 3.15 В
Не нашли, что искали? Воспользуйтесь поиском: