
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Гидрокси- и аминокислоты
Гидроксикислотами называют соединения, содержащие в молекуле одновременно гидроксильную и карбоксильную группы. Аминокислоты содержат в молекуле аминогруппу и карбоксильную группу.
В алифатическом ряду по взаимному расположению функциональных групп различают α-, β-, γ- и т. д. гидрокси- и аминокислоты. Буквой греческого алфавита указывают положение другой функциональной группы относительно карбоксильной, при этом отсчет ведется от ближайшего к карбоксильной группе атома углерода, т. е. от атома С-2. Отметим, что в заместительной номенклатуре для замещенных карбоновых кислот локанты α-, β-, γ- и т. д. не употребляются.
Кислотно-основные свойства. В гетерофункциональных соединениях в зависимости от природы функциональных групп и их местоположения в молекуле возможно усиление или, наоборот, ослабление некоторых свойств, характерных для монофункциональных соединений. Например, кислотность гидроксикислот выше, чем незамещенных кислот. Аминокислоты, содержащие одновременно кислотные и основные фунциональные группы, проявляют амфотерные свойства, т. е. способность взаимодействовать как с кислотами, так и с основаниями. В нейтральных водных растворах или кристаллическом состоянии аминокислоты существуют преимущественно в форме внутренних солей (диполярных ионов), как показано на примере γ-аминомасляной кислоты.

α -Гидрокси- и α -аминокислоты. У α-гидроксикислот и α-аминокислот функциональные группы близки, но внутримолекулярного взаимодействия между ними не происходит из-за неустойчивости трехчленных циклов, которые могли бы при этом образоваться. При нагревании α-гидрокси- и α-аминокислоты претерпевают межмоле- кулярную циклизацию с образованием продуктов, называемых соответственно лактидами и дикетопиперазинами (последнее - от названия шестичленного гетероцикла с двумя атомами азота - пиразина).
Лактиды содержат две сложноэфирные группы, дикетопиперазины - две амидные группы.

Лактиды и дикетопиперазины, являясь сложными эфирами или амидами соответственно, в условиях кислотного или основного ката- лиза способны гидролизоваться с образованием исходных α-гидрокси- или α-аминокислот.
Особое свойство α-гидроксикислот заключается в их способности разлагаться при нагревании в присутствии минеральных кислот с образованием карбонильных соединений и муравьиной кислоты.

Молочная кислота известна как продукт молочнокислого брожения лактозы, содержащейся в молоке, и других углеводов, входящих в состав овощей и плодов.
В организме L-(+)-молочная кислота является одним из продуктов превращения глюкозы (гликолиза). Она накапливается в мыш- цах при интенсивной работе, вследствие чего в них возникает характерная боль. Причина накопления молочной кислоты - недостаток
кислорода, что вызывает восстановление пировиноградной кислоты с участием НАДН в молочную.

Во время отдыха запасы кислорода возобновляются, и молочная кислота окисляется снова в пировиноградную кислоту.
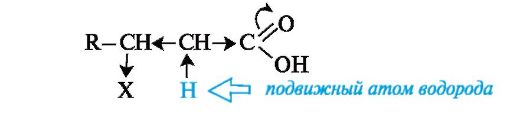
β -Гидрокси- и β -аминокислоты. Характерное общее свойство этих гетерофункциональных кислот заключается в способности к элиминированию молекулы воды или соответственно аммиака с образованием α,β-ненасыщенных кислот.

Реакции элиминирования протекают в мягких условиях. Это объясняется высокой протонной подвижностью α-атома водорода, обусловленной электронным влиянием двух электроноакцепторных
групп (Х и СООН).
γ -Гидрокси- и γ -аминокислоты. Эти кислоты, как и кислоты с δ-расположением функциональных групп, при нагревании претерпевают внутримолекулярную циклизацию. Из гидроксикислот при этом образуются циклические сложные эфиры - лактоны, из аминокислот - циклические амиды - лактамы. Лактоны легко образуются уже при незначительном нагревании, а также в кислой среде.

Принципиально так же происходит внутримолекулярное взаимодействие амино- и карбоксильной групп в γ- и δ-аминокислотах.

Лактоны и лактамы, будучи соответственно сложными эфирами и амидами, гидролизуются в кислой или щелочной среде.
4-Гидроксимасляная кислота (традиционно называемая γ-гидроксимасляной кислотой, ГОМК) применяется в виде натриевой соли как снотворное средство, а также в анестезиологии.
4-Aминомасляная кислота (ГАМК - сокращение от γ-аминомасляной кислоты) принимает участие в обменных процессах, происходящих в головном мозге, является нейромедиатором. В медицинской практике под названием гаммалон, или аминалон, применяется в качестве ноотропного средства.
Важное значение для медицины имеют производные «циклической формы ГАМК» - ее лактама (γ-бутиролактам, или пирроли- дон-2). Производное пирролидона-2 под названием пирацетам (или ноотропил) рассматривается как первый представитель ноотропных средств.
Полимер N-винилпирролидона-2 - поливинилпирролидон в виде водного раствора применяется в качестве заменителя синовиальной жидкости.

Многоосновные гидроксикислоты. Рассматриваемые в этом разделе яблочная, лимонная, изолимонная кислоты, а также щавелевоуксусная (см. 9.2.4) и рассмотренные ранее янтарная и фумаровая (см. 8.1.2) кислоты являются участниками цикла трикарбоновых кислот, называемого также циклом лимонной кислоты, или циклом Кребса. Это универсальный этап окислительного катаболизма углеводов и других соединений в присутствии кислорода.
Происходящие в организме превращения этих кислот являются по своей химической сути реакциями окисления или восстановления. Для каждой из этих кислот реакции катализируются специфическими
ферментами с использованием коферментов. Для окислительно-восстановительных процессов наиболее характерно участие коферментов никотинамидной природы, строение и свойства которых детально рассмотрены далее (см. 14.3.2). В нижеприводимом изложении используются только их сокращенные наименования НАД+ и НАДН. Следует учитывать, что с участием НАД+ осуществляются окислительные процессы, а с участием НАДН - восстановительные.
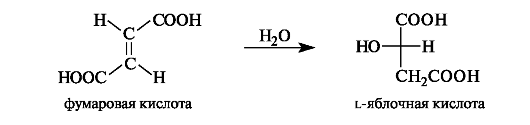
Яблочная кислота в значительных количествах содержится в незрелых яблоках, рябине, фруктовых соках. В организме l-яблочная кислота образуется путем гидратации фумаровой кислоты.
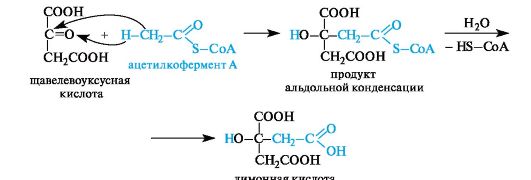
Лимонная кислота содержится в плодах цитрусовых (лимоны, апельсины), винограде, крыжовнике, а также в листьях табака.
Биосинтез лимонной кислоты происходит по типу альдольной конденсации из щавелевоуксусной кислоты и ацетилкофермента А
(см. 8.3.2).
При последующей дегидратации лимонной кислоты как β-гидроксикарбоновой кислоты получается цис-аконитовая кислота, которая далее гидратируется с образованием изолимонной кислоты.
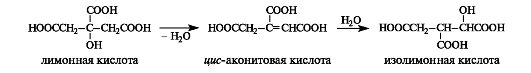
Винные кислоты - представители дигидроксидикарбоновых кислот, содержат два асимметрических атома углерода и поэтому должны были бы существовать в виде четырех стереоизомеров, но в действительности известны три стереоизомера (см. 7.1.3).
D -(+)-Bинная кислота, или обыкновенная винная кислота, известна под названием виннокаменной кислоты. Она содержится в ви- нограде, рябине. Кислая калиевая соль трудно растворима в воде. Она осаждается в винных бочках в виде так называемого винного камня. При нейтрализации этой соли гидроксидом натрия образуется смешанная калиево-натриевая соль. Действием на нее гидроксида меди(II) в щелочной среде получают жидкость Фелинга - реактив для обнаружения альдегидной группы (см. 11.1.5).
L-(-)-Винная кислота в очень небольшом количестве содержится в виноградных винах.
Мезовинная кислота (см. 7.1.3) в природе не встречается; она частично образуется при длительном нагревании в щелочном растворе любого из ее стереоизомеров.
Виноградная кислота (т. пл. 205?С) представляет собой рацемат d- и l-винных кислот, оптической активностью не обладает и отличается по физическим свойствам от индивидуальных энантиомеров.
Оксокислоты
Оксокислотами называют соединения, содержащие в молекуле одновременно карбоксильную и альдегидную (или кетонную) группы.
В соответствии с этим различают альдегидокислоты и кетонокислоты.
Простейшей альдегидокислотой является глиоксалевая (глиоксиловая) кислота, которая обычно существует в виде гидрата (НО)2СНСООН. Она содержится в недозрелых фруктах, но по мере созревания ее количество уменьшается.
Важную роль в биохимических процессах играют кетонокислоты - пировиноградная, ацетоуксусная и щавелевоуксусная (см. табл. 9.2).
Пировиноградная кислота является одним из промежуточных продуктов молочнокислого и спиртового брожения углеводов. Своим названием пировиноградная кислота обязана тому, что впервые была выделена при пиролизе виноградной кислоты.
Пировиноградная кислота декарбоксилируется при нагревании с разбавленной и декарбонилируется (отщепляет СО) - с концент- рированной серной кислотой.

При ферментативном декарбоксилировании пировиноградной кислоты получается ацетальдегид, связанный с коферментом («активный ацетальдегид»). Он может окисляться в присутствии кофермента А в ацетилкофермент А.

Производным пировиноградной кислоты является фосфоенолпировиноградная кислота (фосфат енольной формы кислоты). В организме анион этой кислоты - фосфоенолпируват - образуется в процессе гликолиза и служит предшественником пирувата.

Щавелевоуксусная кислота одновременно является α- и β-оксокислотой. Она образуется при окислении яблочной кислоты.

Далее щавелевоуксусная кислота при конденсации с ацетилкоферментом А превращается в лимонную кислоту (см. 9.2.3).
Ацетоуксусная кислота - представитель β-оксокислот. В свободном состоянии представляет сиропообразную жидкость, медленно выделяющую диоксид углерода.

Как продукт окисления 3-гидроксимасляной кислоты наряду с продуктами ее превращений накапливается в организме больных сахарным диабетом (так называемые ацетоновые, или кетоновые тела, см. Приложение 10-2).

Большое теоретическое значение в связи с вопросами таутомерии и двойственной реакционной способности имеет этиловый эфир ацетоуксусной кислоты, называемый просто ацетоуксусным эфиром.
Ацетоуксусный эфир - жидкость с приятным фруктовым запахом. Впервые синтезирован более 100 лет назад, его строение долгое время было предметом острых дискуссий. Основная трудность заключалась в том, что в результате его химических превращений получались два ряда производных - ацетоуксусной и 3-гидроксикротоновой кислот, т. е. ацетоуксусный эфир проявлял двойственную реакционную способность.
Исследования показали, что ацетоуксусный эфир представляет собой смесь двух изомеров - кетона (92,5%) и енола (7,5 %), находящихся в таутомерном равновесии. Это еще один пример кето-енольной таутомерии, описанной ранее на примере ацетилацетона (см. 8.4).
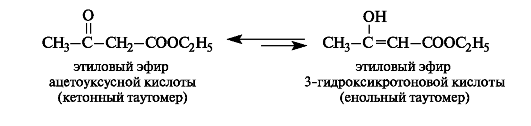
При действии на ацетоуксусный эфир какого-либо реагента в реакцию вступает один из таутомеров. Поскольку второй таутомер в результате равновесия восполняет убыль реагирующего таутомера, таутомерная смесь реагирует в данном направлении как одно целое.
Не нашли, что искали? Воспользуйтесь поиском: