
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Bacillus subtilis 23 29 страница

| a = | m ln 2 | , | |||
| Nt − N 0 | |||||
Використовуючи тест Лурія –Дельбрюка, можна обчислити значення m за часткою проб, у яких не відбулося жодної мутації Р0 за такою формулою:
m = −ln P 0,
тоді:
a = −(ln P 0)(ln 2) .
Nt − N 0

Під час тестування слід враховувати такі фактори:
• вихідне число клітин, що їх висівають у незалежні культури, має бути невелике (для E. coli 10–100 клітин). Це зменшує ймовірність потрапляння в пробу висіву раніше виниклих мутантних клітин;
• тривалість росту і об'єм незалежних культур також мають бути обмежені. Потрібно пам'ятати, що у разі використання надто численних популяцій незалежних культур розходження між ними нівелюються через нагромадження великої кількості розподілених у часі мутацій;
• всі культури слід висівати однаковою кількістю клітин й інкубувати в ідентичних умовах.
Завдання на виконання
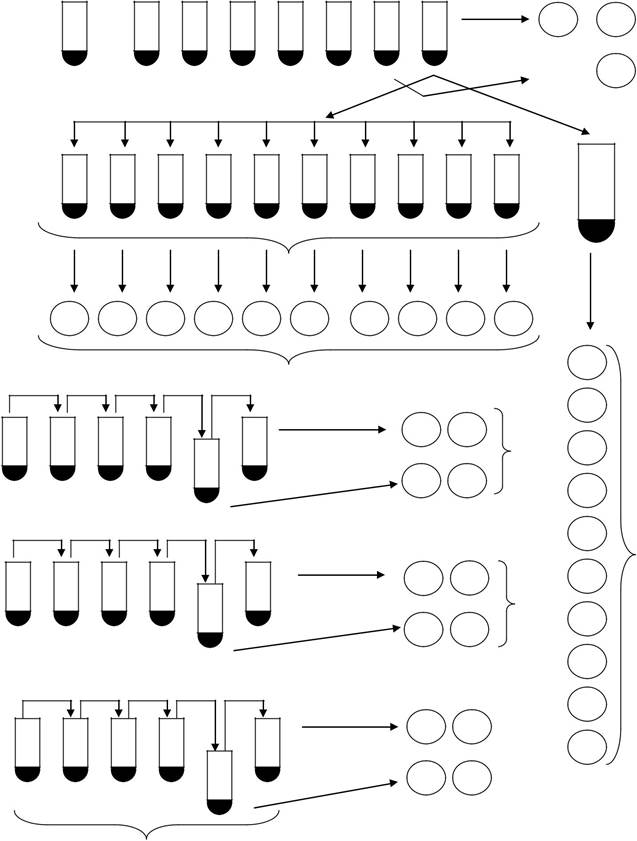
1. Для виконання роботи використовують культуру E. coli К12 Hfr, вирощену на повному середовищі концентрацією близько 2·109 клітин/мл (рис. 6.1). Для її одержання бактеріальні клітини висівають за 16 – 18 год на повному середовищі, інкубують при температурі 37 °С з аерацією. Кожен студент отримує 2 мл вихідної культури.
2. Для одержання незалежних культур з вихідної суспензії готують сім десятикратних розведень суспензії у фосфатному буфері. З останнього розведення відбирають пробу 0,1 мл і вносять у пробірку з 2 мл повного середовища,
| 0,5 мл | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 | |||||||








Вихідна
 культура
культура
E. coli, 2·109
кл./мл
Фосфатний буфер, 4,5 мл
10 Ч 0,1 мл
ПС по 2 мл,
інкубація 37° С,
18-24 год
ПА +
0,5 0,5 0,5 0,5 0,5
2Ч0,1
2Ч0,1
0,5 0,5 0,5 0,5 0,5
2Ч0,1
2Ч0,1
0,5 0,5 0,5 0,5 0,5
2Ч0,1
2Ч0,1
2Ч0,1 мл
2Ч0,1 мл 
1 мл
10 мл
| ПА | |
| ПА | ПА + стрептоміцин |
 ПА ПА
|
Фосфатний буфер, 4,5 мл Ч 6Ч 3
Рис.6.1. Схема постановки флуктуаційного тесту Лурія й Дельбрюка (ПА – повне агаризоване середовище)
пробірки вміщують у термостат з температурою 37 °С на 18 – 24 год. Для визначення концентрації життєздатних клітин у вихідній культурі (і, отже, для визначення кількості клітин, засіяних у незалежні культури) з шостого й сьомого розведень вихідної суспензії висівають три проби по 0,1 мл на дві чашки з ПА (всього шість чашок). Засіяні чашки розміщують у термостаті з температурою 37 °С на 24 год.
3. Із пробірок, засіяних з останнього розведення вихідної культури, проводять висів на повне агаризоване середовище зі стрептоміцином для визначення вмісту стійких до антибіотика клітин. Культури в перших десяти пробірках приймають за незалежні, в одинадцятій – за окрему. З незалежних культур висівають по одній пробі по 0,1 мл (всього десять чашок повного агаризованого середовища зі стрептоміцином). З одинадцятої пробірки висівають десять проб по 0,1 мл на десять чашок з ПА зі стрептоміцином. Кожну пробу по 0,1 мл відбирають окремою мікропіпеткою з максимальною точністю й розтирають на селективному середовищі окремим шпателем.
4. Слід ще визначити концентрацію життєздатних клітин у незалежних культурах. З цією метою проводять серійні розведення (до 10–7) із трьох довільно вибраних незалежних культур. Передбачається, що у всіх незалежних культурах за час інкубації виростає приблизно однакова кількість клітин. З п’ятого й шостого розведень кожної серії висівають по дві проби пo 0,1 мл на чашки з повним агаризованим середовищем (усього 12 чашок). Чашки інкубують при температурі 37 °С протягом 24 год, чашки з повним агаризованим середовищем і стрептоміцином – 48 годин.
Опрацювання результатів
1. Після пророщення культури в чашках Петрі проводять підрахунок вирослих колоній для визначення титру вихідної культури, і результати заносять у табл. 6.1.
| Концентрація клітин у вихідній і незалежній культурах | Таблиця 6.1 | ||||||
| Розве- | Вихідна культура | Незалежна культура | |||||
| Кількість | Концентра- | Номер | Розве- | Кількість | Концен - | ||
| дення | колоній у | ція клітин | пробірки | дення | колоній | трація | |
| чашках | клітин | ||||||
2. Для визначення титрів незалежних культур і кількості стрептоміцинстійких клітин у пробах з незалежних і окремих культур рахують колонії, що виросли на чашках з повним агаризованим середовищем і на чашках з повним агаризованим середовищем і стрептоміцином. Результати підрахунку кількості життєздатних клітин у культурах вносять у табл. 6.2.
| Таблиця 6.2 | ||||
| Аналіз стрептоміцинстійких клітин | ||||
| Кількість стійких до | Кількість стійких до | |||
| Номер | Номер | стрептоміцину клітин у | ||
| стрептоміцину клітин у | ||||
| проби | культури | пробах з незалежних | ||
| пробах з окремої культури | ||||
| культур | ||||
Не нашли, что искали? Воспользуйтесь поиском: