
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Визначення стехіометричної формули речовини
У кристалічній структурі положення частинок речовини збігається з вузлами решітки або частинки розміщуються навколо вузлів симетричними групами. Визначення хімічної (стехіометричної) формули речовини грунтується на підрахунку числа атомів кожного сорту, що припадають на один елементарний осередок.
Число структурних одиниць показує, скільки треба взяти атомів (молекул) даної хімічної сполуки, щоб побудувати один елементарний осередок. Так, для кристала типу АВ, наприклад NaCl (див. рисунок 1.11 а), на один осередок припадає по чотири атоми А і В. Отже, число структурних одиниць Z=4.
Число Z завжди більше одиниці й набуває лише цілих чисельних значень.
Приклади визначення стехіометричної формули речовини:
У структурі CsCl (рисунок 1.11 б) один атом Сl перебуває в центрі осередку, атоми Cs займають 8 вершин, тобто на 1 осередок припадає 8x1/8=1 атом Cs, отже, А: В= 1:1, стехіометрична формула АВ (CsCl), Z=2.
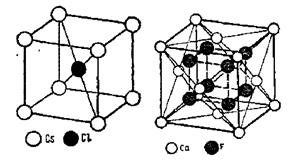
Рисунок 1.11 - Схеми структур CsCl(a) та Ca2F для визначення стехіометричних формул
У структурі флюориту Ca2F (рисунок 1.11) атоми Са займають вузли гранецентрованого осередку, число структурних одиниць типу А (Са) дорівнює 4. У найпростіших структурах для підтвердження хімічної формули сполуки можна використовувати координаційні числа. Так, у структурі хлористого натрію (КЧ NaCl=6) відношення координаційних чисел 6:6=1:1, що приводить до стехіометричної формули АВ (NaCl).
У структурі флюориту КЧ Са=8, КЧ FCa=4, відношення координаційних чисел дорівнює 8:4= =2:1, стехіометрична формула АВ2 (Ca2F).
За КЧ зручно класифікувати структури бінарних сполук (АВ, АВ2 і т.д.).
Поляризація
Під впливом електричного поля, створюваного сусіднім іоном, у кристалічній решітці відбувається деформація кулястої форми іонів, тобто зміна їхніх точних радіусів. Це явище називається поляризацією.
Як приклад поляризації розглянемо сполуку КВr. Тут позитивно заряджений великий іон калію притягає до себе електронну оболонку брому, а негативний іон брому, у свою чергу, трохи змінює (деформує) оболонку калію.
На поляризацію впливають такі фактори:
1) розміри іонів. Зі збільшенням розміру іона збільшується відстань електронних оболонок іона від його ядра. Отже, чим більший іон, тим слабші електронні оболонки, пов'язані з ядром, у зв'язку з чим він буде легко поляризуватися (деформуватися). Іони ж маленького розміру будуть поляризуватися важче;
2) валентність іона. Чим більше зарядів несе іон, тим більше його валентність, тим важче він поляризується. У той самий час відомо, що при підвищенні валентності елемента розмір його іона зменшується. Отже, чим більша валентність іона, тим важче він поляризується, але сам добре поляризує.
Явище поляризації значно впливає на всі кристалохімічні й фізико-хімічні властивості речовини. У результаті поляризації в сполуках підсилюється ковалентність зв'язку, у деяких випадках змінюється координаційне число, зменшується розчинність, скляний блиск змінюється на алмазний і т.п.
Частина ІІІ
Мінералогія
Не нашли, что искали? Воспользуйтесь поиском: