
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Координаційні числа й координаційні
Багатогранники
Число атомів (іонів протилежного знака), складове найближче оточення даного атома (іона), називається його координаційним числом, а геометрична фігура, що виходить при сполученні центрів цих атомів (іонів) прямими лініями, - його координаційним «багато-гранником».
У структурі міді Сu (рисунок 1. 10) кожний атом міді оточений дванадцятьма найближчими до нього такими ж атомами, розміщеними по вершинах кубооктаедра. Наприклад, до координаційного багато-гранника атома 1 належать атоми 2, 2, 2 і інші, не зображені на рисунку атоми, що віддалені від нього на відстані, що дорівнює половині гранної діагоналі осередку 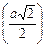 . Таким чином, координаційне число атома міді в її структурі дорівнює 12, координаційний багатогранник - кубооктаедр.
. Таким чином, координаційне число атома міді в її структурі дорівнює 12, координаційний багатогранник - кубооктаедр.
У структурі повареної солі NaCl (рисунок 1.10.) навколо кожного іона натрію розміщуються по октаедру шість найближчих іонів хлору, і навпаки, навколо кожного іона хлору розміщуються по октаедру шість найближчих іонів натрію. Отже, координаційне число натрію в структурі NaCl дорівнює 6, координаційний багатогранник - октаедр; координаційне число хлору в тій самій структурі дорівнює 6, координаційний багатогранник - октаедр.

Рисунок 1.10 - Схеми структур міді(а) та повареної солі (б) для визначення координаційного числа (КЧ) та координаційного багатогранника
У випадку іонних решіток у структурі поєднуються іони різних радіусів, тому координаційне число (тобто число атомів, що групуються навколо кожного катіона або число катіонів, що оточують аніон) буде залежати від відношення радіуса катіона Rк до радіуса аніона Ra, тобто від величини Rк: Rа.
Координаційні числа зумовлюють різне розміщення аніонів і катіонів і, отже, дозволяють визначити характерні особливості структур тієї або іншої хімічної сполуки.
Якщо координаційне число дорівнює 2, що може бути при відношенні
Rк: Ra ≤ 0.15 ≤ 0.22, то два аніони будуть перебувати на рівній відстані від катіона й утворювати фігуру у вигляді гантелі.
Аналогічно для інших (див. таблицю 1.2).
Таблиця 1.2-Відношення радіусів залежно від КЧ
| Координаційне число | Форма координаційного поліедра | Відношення радіусів |
| Гантель Трикутник Тетраедр Октаедр Куб Кубооктаедр | від 0 до 0.15 від 0.15 до 0.22 від 0.22 до 0.41 від 0.41 до 0.73 від 0.73 до 1.37 |
Не нашли, что искали? Воспользуйтесь поиском: