
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Важнейшие заболевания, синдромы, признаки избытка никеля.
• Профессиональные интоксикации никелем, сопровождающиеся литейной лихорад
кой, ринитом, носовыми кровотечениями, отеком легких, токсической пневмонией,
пневмосклерозом, гепатитом, постнекротическим циррозом; никелевым дерматитом
(никелевая чесотка, никелевая экзема); изъязвлениями слизистой оболочки носа.
• Никелевый рак слизистой оболочки носа, его придаточных пазух, бронхогенный рак
легких.

 Г л а в а 5 СИСТЕМА ГЕМОСТАЗА
Г л а в а 5 СИСТЕМА ГЕМОСТАЗА


 Система гемостаза — совокупность функционально-морфологических и биохимических механизмов, обеспечивающих сохранение жидкого состояния крови, предупреждение и остановку кровотечений, а также целости кровеносных сосудов.
Система гемостаза — совокупность функционально-морфологических и биохимических механизмов, обеспечивающих сохранение жидкого состояния крови, предупреждение и остановку кровотечений, а также целости кровеносных сосудов.
В целостном организме при отсутствии каких-либо патологических воздействий жидкое состояние крови является следствием равновесия факторов, обусловливающих процессы свертывания и препятствующих их развитию. Нарушение подобного баланса может быть вызвано очень многими факторами, однако вне зависимости от этиологических причин тром-бообразование в организме происходит по единым законам с включением в процесс определенных клеточных элементов, энзимов и субстратов.
В свертывании крови различают два звена: клеточный (сосудисто-тромбоцитарный) и плазменный (коагуляционный) гемостаз.
Под клеточным гемостазом понимают адгезию клеток (т.е. взаимодействие клеток с чужеродной поверхностью, в том числе и с клетками иного вида), агрегацию (склеивание одноименных клеток крови между собой), а также высвобождение из форменных элементов веществ, активирующих плазменный гемостаз.
Плазменный (коагуляционный) гемостаз представляет собой каскад реакций, в которых участвуют факторы свертывания крови, завершающийся процессом фибринообразования. Образовавшийся фибрин подвергается далее разрушению под влиянием плазмина (фибри-нолиз).
Важно отметить, что деление гемостатических реакций на клеточные и плазменные является условным, однако оно справедливо в системе in vitro и существенно облегчает выбор адекватных методик и интерпретацию результатов лабораторной диагностики патологии гемостаза. В организме эти два звена свертывающей системы крови тесно связаны и не могут функционировать раздельно.
Очень важную роль в осуществлении реакций гемостаза играет сосудистая стенка. Эндо-телиальные клетки сосудов способны синтезировать и/или экспрессировать на своей поверхности различные биологически активные вещества, модулирующие тромбообразование. К ним относятся фактор Виллебранда, эндотелиальный фактор релаксации (оксид азота), простациклин, тромбомодулин, эндотелии, активатор плазминогена тканевого типа, ингибитор активатора плазминогена тканевого типа, тканевый фактор (тромбопластин), ингибитор пути тканевого фактора и некоторые другие. Кроме того, мембраны эндотелиоцитов несут на себе рецепторы, которые при определенных условиях опосредуют связывание с молекулярными лигандами и клетками, свободно циркулирующими в кровотоке.
При отсутствии каких-либо повреждений выстилающие сосуд эндотелиальные клетки обладают тромборезистентными свойствами, что способствует поддержанию жидкого состояния крови. Тромборезистентность эндотелия обеспечивается:
♦ контактной инертностью внутренней, обращенной в просвет сосуда поверхности этих
клеток;
♦ синтезом мощного ингибитора агрегации тромбоцитов — простациклина;
♦ наличием на мембране эндотелиоцитов тромбомодулина, который связывает тром
бин; при этом последний утрачивает способность вызывать свертывание крови, но со
храняет активирующее действие на систему двух важнейших физиологических анти
коагулянтов — протеинов С и S;
♦ высоким содержанием на внутренней поверхности сосудов мукополисахаридов и фик
сацией на эндотелии комплекса гепарин—антитромбин III;
16- 243
♦ способностью секретировать и синтезировать тканевый активатор плазминогена,
обеспечивающий фибринолиз;
♦ способностью стимулировать фибринолиз через систему протеинов С и S.
Нарушение целости сосудистой стенки и/или изменение функциональных свойств эн-дотелиоцитов могут способствовать развитию протромботических реакций — антитромботи-ческий потенциал эндотелия трансформируется в тромбогенный. Причины, приводящие к травме сосудов, весьма разнообразны и включают в себя как экзогенные факторы (механические повреждения, лучевое воздействие, гипер- и гипотермия, токсические вещества, в том числе и лекарственные препараты, и т.п.), так и эндогенные факторы. К последним относятся биологически активные вещества (тромбин, циклические нуклеотиды, ряд цитоки-нов и т.п.), способные при определенных условиях проявлять мембраноагрессивные свойства. Такой механизм поражения сосудистой стенки характерен для многих заболеваний, сопровождающихся склонностью к тромбообразованию.
Абсолютно все клеточные элементы крови принимают участие в тромбогенезе, но для тромбоцитов (в отличие от эритроцитов и лейкоцитов) прокоагулянтная функция является основной. Тромбоциты не только являются главными клеточными участниками процесса тромбообразования в артериях и важными компонентами, обеспечивающими флеботромбоз, но также обладают существенным влиянием на другие звенья гемокоагуляции, представляя активированные фосфолипидные поверхности, необходимые для реализации процессов плазменного гемостаза, высвобождая в кровь ряд факторов свертывания, модулируя фибринолиз и нарушая гемодинамические константы как путем транзиторной вазоконстрикции, обусловленной генерацией ТХА2 (тромбоксан А2), так и путем образования и выделения ми-тогенных факторов, способствующих гиперплазии сосудистой стенки. При инициации тром-богенеза происходит активация тромбоцитов (т.е. активация тромбоцитарных гликопротеи-нов и фосфолипаз, обмен фосфолипидов, образование вторичных посредников, фосфорили-рование белков, метаболизм арахидоновой кислоты, взаимодействие актина и миозина, №+/Н+-обмен, экспрессия фибриногеновых рецепторов и перераспределение ионов кальция) и индукция процессов их адгезии, реакции высвобождения и агрегации; при этом адгезия предшествует развитию реакции высвобождения и агрегации тромбоцитов и является первой ступенью формирования гемостатического процесса.
При нарушении эндотелиальной выстилки субэндотелиальные компоненты сосудистой стенки (фибриллярный и нефибриллярный коллаген, эластин, протеогликан и др.) вступают в контакт с кровью и образуют поверхность для связывания фактора Виллебранда, который не только стабилизирует фактор VIII в плазме, но и играет ключевую роль в процессе адгезии тромбоцитов, связывая субэндотелиальные структуры с рецепторами клеток (схема 5.1). Следует отметить, что взаимодействие тромбоцитарных рецепторов с фактором Виллебранда возможно только при наличии сил, создаваемых кровотоком.
Адгезия тромбоцитов к тромбогенной поверхности сопровождается их распластыванием. Этот процесс необходим для осуществления более полного взаимодействия тромбоцитарных рецепторов с фиксированными лигандами, что способствует дальнейшему прогрес-сированию тромбообразования, так как, с одной стороны, обеспечивает более прочную связь адгезированных клеток с сосудистой стенкой, а с другой стороны иммобилизованные фибриноген и фактор Виллебранда способны выступать в качестве тромбоцитарных агонистов, способствуя дальнейшей активации этих клеток.
Помимо взаимодействия с чужеродной (в том числе и поврежденной сосудистой) поверхностью, тромбоциты способны прилипать друг к другу, т.е. агрегировать. Агрегацию тромбоцитов вызывают различные по своей природе вещества, например тромбин, коллаген, АДФ, арахидоновая кислота, тромбоксан А2, простагландины G2 и Н2, серотонин, адреналин, фактор активации тромбоцитов и др. Проагрегантами могут быть и вещества, отсутствующие в организме, например латекс.
Как адгезия, так и агрегация тромбоцитов могут приводить к развитию реакции высвобождения — специфического Са2+-зависимого секреторного процесса, при котором тромбоциты выбрасывают содержимое некоторых своих внутриклеточных образований в экстрацеллюлярное пространство. АДФ, адреналин, субэндотелиальная соединительная ткань и тромбин являются физиологически важными агентами, индуцирующими реакцию высвобождения. Вначале высвобождается содержимое плотных гранул: АДФ, серотонин, Са2+; высвобождение содержимого а-гранул (тромбоцитарный фактор 4, р-тромбоглобу-лин, тромбоцитарный фактор роста, фактор Виллебранда, фибриноген и фибронектин) требует более сильной стимуляции тромбоцитов. Липосомальные гранулы, содержащие
 Схема 5.1. ТРОМБОЦИТАРНЫЙ ГЕМОСТАЗ [БАРКАГАН З.С., 1998]
Схема 5.1. ТРОМБОЦИТАРНЫЙ ГЕМОСТАЗ [БАРКАГАН З.С., 1998]
ПОВРЕЖДЕНИЕ СОСУДА
Г" Коллаген
АДФ
■ Лабилизация-
мембраны
тромбоцитов
I___________
Гемолиз
Высвобождение Са2+
|
| АГРЕГАЦИЯ I |
| АГРЕГАЦИЯ II |
Фактор Виллебранда-
| Са, Mg, белковые плазменные кофакторы |
Реакция высвобождения (АДФ, адреналин и др.)
АДГЕЗИЯ
Т
Изменение формы, образование отростков, активация фосфолипазы А2
Арахидоновая кислота.Тромбоксан Аг
Реакция высвобождения (4-й фактор, (З-тромбоглобулин, ростовой фактор, тромбоспондин)

 СГУСТОК, ТРОМБ
СГУСТОК, ТРОМБ
Тромбин
Фибриноген
Фибрин


 РЕТРАКЦИЯ
РЕТРАКЦИЯ
 Примечание: -» — активация, — переход из одного состояния в другое.
Примечание: -» — активация, — переход из одного состояния в другое.
кислые гидролазы, высвобождаются только в присутствии концентрированного коллагена или тромбина. Следует отметить, что высвободившиеся из тромбоцитов факторы способствуют закрытию дефекта сосудистой стенки и развитию гемостатической пробки, однако при достаточно выраженном поражении сосуда дальнейшая активация тромбоцитов и их адгезия к травмированному участку сосудистой поверхности формирует основу для развития распространенного тромботического процесса с последующей окклюзией сосудов.
В любом случае итогом повреждения эндотелиоцитов является приобретение интимой сосудов прокоагулянтных свойств, что сопровождается синтезом и экспрессией тканевого фактора (тромбопластина) — основного инициатора процесса свертывания крови. Тромбо-пластин, который хотя и не обладает энзиматической активностью, может выступать в роли кофактора активированного фактора VII. Комплекс тромбопластин—фактор VII способен активировать как фактор X, так и фактор XI, вызывая тем самым генерацию тромбина, что в свою очередь индуцирует дальнейшее прогрессирование реакций как клеточного, так и плазменного гемостаза.
Гемостатические реакции, совокупность которых принято называть плазменным (коагу-ляционным) гемостазом и итогом которых является образование фибрина, обеспечиваются в основном протеинами, носящими название плазменных факторов. В табл. 5.1 приведен перечень факторов, участвующих в свертывании крови.
Процесс протекания плазменного гемостаза можно условно разделить на три фазы.
Первая фаза — протромбиназообразование, или контактно-калликреин-кинин-каскад-ная активация. Первая фаза представляет собой многоступенчатый процесс, в результате которого в крови накапливается комплекс факторов, способных превратить протромбин в тромбин, поэтому комплекс называется протромбиназой. В зависимости от пути формирова-
Таблица 5.1. Международная номенклатура факторов свертывания крови
| Период | ||
| Факторы | Синонимы | полураспада, |
| часы | ||
| I | Фибриноген* | 72-120 |
| II | Протромбин* | 48-96 |
| III | Тканевый тромбопластин, тканевый фактор | — |
| IV | Ионы кальция | — |
| V | Проакцелерин*, Ас-глобулин | 15-18 |
| VI | Акцелерин (исключен из употребления) | |
| VII | Проконвертин* | 4-6 |
| VIII | Антигемофильный глобулин А | 7-8 |
| IX | Кристмас-фактор, плазменный тромбопластиновый | 15-30 |
| компонент, антигемофильный фактор В* | ||
| X | Фактор Стюарта—Прауэра* | 30-70 |
| XI | Антигемофильный фактор С | 30-70 |
| XI | Фактор Хагемана, фактор контакта* | 50-70 |
| XIII | Фибриназа, фибринстабилизирующий фактор | |
| Дополнительные факторы | ||
| Фактор Виллебранда | 18-30 | |
| Фактор Флетчера, плазменный прекалликреин | — | |
| Фактор Фитцжеральда, высокомолекулярный кининоген | — |
*Синтезируется в печени.
ния протромбиназы различают внутренний и внешний пути ее формирования. По внутреннему пути свертывание крови инициируется без участия тканевого тромбопластина; в образовании протромбиназы принимают участие факторы плазмы (XII, XI, IX, VIII, X), калли-креин-кининовая система и тромбоциты. В результате инициации реакций внутреннего пути образуется комплекс факторов Ха с V на фосфолипидной поверхности (3-й фактор тромбоцитов) в присутствии ионизированного кальция. Весь этот комплекс действует как протром-биназа, превращая протромбин в тромбин. Пусковым фактором этого механизма является фактор XII, который активируется либо вследствие контакта крови с чужеродной поверхностью, либо при контакте крови с субэндотелием (коллагеном) и другими компонентами соединительной ткани при повреждении стенок сосудов, либо фактор XII активируется путем его ферментативного расщепления (калликреином, плазмином, другими протеазами). Во внешнем пути формирования протромбиназы основную роль играет тканевый фактор (фактор III), который экспрессируется на клеточных поверхностях при повреждении тканей и образует с фактором Vila и ионами кальция комплекс, способный перевести фактор X в фактор Ха, который и активирует протромбин. Кроме того, фактор Ха ретроградно активирует комплекс тканевого фактора + фактора Vila. Таким образом, внутренний и внешний пути соединяются на факторах свертывания. Однако так называемые «мосты» между этими путями реализуются через взаимную активацию факторов XII, VII и IX. Эта фаза длится от 4 мин 50 с до 6 мин 50 с (схема 5.2).
Вторая фаза — тромбинообразование. В эту фазу протромбиназа вместе с факторами коагуляции V, VII, X и IV переводит неактивный фактор II (протромбин) в активный фактор Па — тромбин. Эта фаза длится 2—5 с.
Третья фаза свертывания крови — фибринообразование (схема 5.3). Возникший тромбин отщепляет от молекулы фибриногена два пептида А и два В, переводит его в фибрин-мономер. Молекулы последнего полимеризуются сначала в димеры, затем в еще растворимые, особенно в кислой среде, олигомеры, и фибрин-папилляры становятся фибрин-полимером. Кроме того, тромбин способствует превращению фактора XIII в фактор XII 1а. Последний в присутствии Са2+ изменяет фибрин-полимер из лабильной, легко растворимой фибриноли-зином (плазмином) формы в медленно и ограниченно растворимую форму, составляющую основу кровяного сгустка. Эта фаза длится 2—5 с.
Схема 5.2. ПЛАЗМЕННЫЙ ГЕМОСТАЗ [БАРКАГАН З.С., 1998]
 | |||||
 | |||||
 | |||||
| Прекалликреин l< Калликреин ▼ |
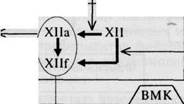 ВНЕШНИЙ ПУТЬ
ВНЕШНИЙ ПУТЬ
Тканевый фактор
Плазменные липопротеиды
ВНУТРЕННИЙ ПУТЬ
Контакт, субэндотелий
Плазминоген
Плазмин
^*\
Фибринолиз

| Тканевый фактор \ |
| V V |
| ■Х1а |
 Ca2t
Ca2t
VII-
XI + ХПа, f + Калликреин
 v
v
 |
| Па+Ц-П + Va + Xa |
| Са2 |
 Ингибиторы самосборки и агрегации протофибрилл
Ингибиторы самосборки и агрегации протофибрилл
Примечание: ВМК — высокомолекулярный кининоген; РФМК — растворимые фибрин-мономерные комплексы; фп А,В — фибринопептиды А и В; Сз, Csb, C9 — факторы системы комплемента.
В процессе образования гемостатического тромба не происходит распространения тром-бообразования от места повреждения стенки сосуда по сосудистому руслу, так как этому препятствуют быстро возрастающий вслед за свертыванием антикоагулянтный потенциал крови и активация фибринолитической системы.
Сохранение крови в жидком состоянии и регуляция скоростей взаимодействия факторов во все фазы коагуляции во многом определяются наличием в кровотоке естественных веществ, обладающих антикоагулянтной активностью. Жидкое состояние крови достигается равновесием между факторами, индуцирующими свертывание крови, и факторами, препятствующими его развитию, причем последние не выделяются в отдельную функциональную систему, так как реализация их эффектов чаще всего невозможна без участия прокоагуляци-онных факторов. Поэтому выделение антикоагулянтов, которые препятствуют активации факторов свертывания крови и нейтрализуют их активные формы, является чисто условным. Вещества, обладающие антикоагулянтной активностью, постоянно синтезируются в организме и с определенной скоростью выделяются в кровоток. К ним относятся: антитромбин III, гепарин, протеины С и S, недавно открытый ингибитор тканевого пути свертывания — TFPI (ингибитор комплекса тканевый фактор—фактор Vila—Са2+), а2-макроглобулин, антитрипсин и др. В процессе свертывания крови, фибринолиза из факторов свертывания и других белков также образуются вещества, обладающие антикоагулянтной активностью. Антикоагулянты оказывают выраженное действие на все фазы свертывания крови, поэтому исследование их активности при нарушениях свертывания крови очень важно.
После стабилизации фибрина, образующего вместе с форменными элементами первичный красный тромб, начинаются два основных процесса посткоагуляционной фазы — спон-
Не нашли, что искали? Воспользуйтесь поиском: