
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Броуновская коагуляция
Смолуховский [2], исходя из предположений, что:
1) частицы соударяются вследствие броуновского движения;
2) частицы слипаются при каждом столкновении;
3) частицы аэрозоля имеют сферическую форму;
4) размер всех частиц одинаков (монодисперсный аэрозоль);
5) форма и размер частиц остаются постоянными, несмотря на их коагуляцию с другими частицами, получил простое уравнение для описания процесса коагуляции:
 , (9)
, (9)
где dn/dt – скорость исчезновения частиц в результате коагуляции; K – константа коагуляции; n – число частиц в элементарном объеме в любой момент времени t.
Теоретически Смолуховский показал, что константа коагуляции равна:
К = 4RTC¢/ 3mgN, (10)
где N – число Авогадро.
Для монодисперсных аэрозолей в воздухе, как показали эксперименты, константы коагуляции частиц из различного типа материала К находятся в интервале значений (0,5–2)× 109 см3/с.
Уравнения (9) и (10) выполняются для частиц радиусом до 20 мкм даже при сильной турбулентности, когда e» 1000 см2 /с3 (e - скорость диссипации (потери) турбулентной энергии).
Согласно Вигнеру [5] для частиц различного размера уравнение коагуляции имеет вид
 , (11)
, (11)
где r = (r1+ r2)/2; 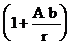 – поправка, характеризующая подвижность частиц в газе (для сферических частиц в воздухе постоянная А= 0,9; b – среднее значение свободного пробега частиц); k=R/N – постоянная Больцмана.
– поправка, характеризующая подвижность частиц в газе (для сферических частиц в воздухе постоянная А= 0,9; b – среднее значение свободного пробега частиц); k=R/N – постоянная Больцмана.
Это уравнение показывает, что коагуляция имеет минимальное значение, когда соударяющиеся частицы имеют одинаковые размеры; частицы сильно различающиеся по размерам соединяются быстрее, чем частицы одинакового размера.
Учитывая, что константа коагуляции K=4kT/3m, уравнение скорости коагуляции для сферических частиц принимает вид
 . (12)
. (12)
2.2. Коагуляция частиц в ламинарном потоке [2]
В ламинарном потоке газа частицы могут сталкиваться и агломерировать вследствие различия их скоростей движения относительно друг друга. Показано, что при малом эффекте броуновской диффузии и аэродинамического взаимодействия между молекулами число частиц, контактирующих с поглощающей сферой в секунду, составляет
Ф = 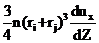 , (13)
, (13)
где ri и rj – радиусы поглощающей сферы и улавливаемой частицы соответственно;  /
/  – градиент скорости частицы в направле-нии х при ее дрейфе по направлению Z.
– градиент скорости частицы в направле-нии х при ее дрейфе по направлению Z.
Градиент скорости коагуляции частиц превышает скорость броуновской диффузии при выполнении следующего условия:
 , (14)
, (14)
где Dp – коэффициент диффузии частицы; rp – радиус частицы; C' – коэффициент Каннингхема для течения со скольжением.
Видно, что даже небольшое изменение размера частицы оказывает значительное влияние на величину градиента скорости.
2.3. Коагуляция частиц в турбулентном потоке [2]
Турбулентность потока оказывает влияние на процесс коагуляции по двум механизмам. Первый из них связан с разностью скоростей флуктуаций среды в двух точках, удаленных на расстоянии (ro + rj). Этот механизм аналогичен коагуляции для случая ламинарного течения. По второму механизму коагуляция протекает вследствие разности в скоростях флуктуации частиц из-за различия в величине инерции. Поскольку инерция частицы зависит от ее размеров, первый из рассмотренных механизмов может приводить к соударениям частиц одинаковых и неодинаковых размеров; второй механизм осуществляется только при столкновении частиц разных размеров.
По первому механизму число частиц радиуса ri, соударяющих-ся со сферой радиуса rj за одну секунду, описывается выражением
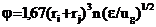 , (15)
, (15)
где e – скорость диссипации (потери) турбулентной энергии, см2/с3; ug – скорость газа, см/с.
Для коагуляции по второму механизму, число столкновений для каждой частицы за 1 с равно
 , (16)
, (16)
где tg и tw – время, за которое происходит основное изменение скорости движения частицы, т. е. время релаксации частицы, и время ее блуждания (кружения) в потоке газа до момента коагуляции, соответственно.
Время релаксации определяется по формуле
t= 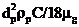 , (17)
, (17)
где dр – диаметр частицы; rр – плотность частицы; С - массовая концентрация частиц; mg – вязкость газа.
2.4. Коагуляция аэрозолей, содержащих электрически заряженные частицы [2]
Наличие электростатических сил в условиях броуновского движения может ускорять или замедлять коагуляцию в зависимости от знака заряда частиц. Число столкновений каждой частицы за одну секунду при дополнительном действии электрических сил равно:
- для незаряженных частиц:
j=8pDrn, (18)
- для заряженного аэрозоля:
j=bjо, (19)
где b = j/ jо; jо – число столкновений для каждой частицы за одну секунду в условиях броуновской коагуляции; D – характеристический размер, безразмерный; r – радиус частицы.
В случае заряженного аэрозоля индукционные силы считаются пренебрежительно малыми и для дипольного заряда при отталкивании частиц с одноименным зарядом величина b равна
b = g/ [exp(g)–1]. (20)
В случае притяжения зарядов
b = çg ç/ [1-exp(–çg ç)], (21)
где g=qiqj/ dpkT; dр – диаметр частицы; qi , qj – заряды частиц.
Оценки показывают, что частицы с противоположным зарядом будут коагулировать быстрее, чем нейтральные, а те, в свою очередь, быстрее, чем частицы с одноименным зарядом. В случае аэрозоля с заряженными частицами, в котором суммарный заряд равен нулю, общий эффект будет очень малым.
3. КОНДЕНСАЦИЯ И ИСПАРЕНИЕ [1, 2, 5]
Конденсация характеризует рост капель аэрозолей за счет механизма диффузии конденсирующихся паров к поверхности капли. В насыщенной или перенасыщенной паром атмосфере частицы аэрозолей выполняют роль центров конденсации. При этом размер частиц возрастает. Если степень перенасыщения паров достаточно высока (более 200 %), то пары способны конденсироваться с образованием капель и без присутствия центров конденсации.
При изучении давления насыщенных паров жидкости у ее поверхности установлено, что над выпуклой поверхностью оно больше, чем над плоской.
Математически это выражается следующей формулой [1]:
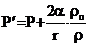 , (22)
, (22)
где Р¢ и Р – давление паров над выпуклой и плоской поверхностью жидкости, соответственно; a – коэффициент поверхностного натяже-ния жидкости; r – плотность жидкости; rо – плотность паров данной жидкости; r – радиус капли.
Из этого уравнения следует, что давление насыщенных паров над сферическими каплями больше, чем над плоской поверхностью жидкости, и тем оно больше, чем меньше радиус капель. Поэтому меньшие капли будут испаряться, а на больших каплях пары будут конденсироваться, пока маленькие капли полностью не испарятся.
Предполагая, что капли жидкости находятся в стационарных условиях с парогазовой средой, Максвелл вывел уравнение для конденсации [5]
 или
или 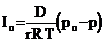 , (23)
, (23)
где Io – скорость конденсации (испарения), моль/(см2∙с); D – коэффициент диффузии пара, см3/с; R - газовая постоянная, равная 0,082 л×атм/град×моль; Т – температура, К; Со – концентрация паров у поверхности капли, моль/см3; ро – парциальное давление паров у поверхности капли или давление пара в капле, дин/см2; С – концентрация пара на достаточно большом расстоянии от капли; р – парциальное давление пара на том же расстоянии от капли.
Фукс видоизменил это уравнение для случая, когда размер капель меньше или сравним со значением пути свободного пробега молекул в парогазовой среде. Скорость конденсации в этом случае определяется по формуле [5]
 , (24)
, (24)
где I – скорость конденсации или испарения, моль/см2∙с; Io – скорость конденсации (испарения) в начальный момент времени; n=(kT/2pm)1/2; a – коэффициент конденсации; D = b l, где l – значение пути свободного пробега в газе; b – константа, равная 1-4 (определяется экспериментально); r – радиус капли.
Коэффициент a представляет собой долю испарившихся молекул и столкнувшихся с поверхностью капли и затем адсорбированных ею, т. е. показывает, какая доля всех молекул, ударяющихся о поверхность капли, конденсируются на ней.
Для стационарной конденсации на неподвижной сферической капле в парогазовой среде изменение ее диаметра в зависимости от времени можно рассчитать по формуле [2]
 , (25)
, (25)
где d – текущий диаметр капли, см; dо – начальный диаметр капли, см; D – коэффициент диффузии пара в газе, см2/с; ро – парциальное давление пара у поверхности капли, кПа; рu – парциальное давление пара в газовой фазе, кПа; ra – плотность жидкости, г/см3; М – масса молекулы жидкости (М=m/N); m, N – молекулярный вес и число Авогадро.
Для конденсации капель, движущихся относительно газового потока, скорость изменения размеров капель описывается уравнением Фросслинга
 , (26)
, (26)
где Rep – число Рейнольдса для частиц (Rep=dp(up–ug) rg/ mg); dр – диаметр частицы; up, ug – скорость частицы и газового потока, соответственно; rg, mg – плотность потока и абсолютная вязкость газа, соответственно); Sc – число Шмидта (Sc=mg/rg×Du, где Du – коэффициент диффузии пара в газе).
Число Рейнольдса для частиц зависит от скорости движения частицы относительно газового потока и свойств жидкости частицы. Число Шмидта есть безразмерная величина, характеризующая отношение скорости диффузионного и конвективного переносов при постоянном числе Рейнольдса.
Для оценки скорости испарения капель, имеющих радиус 2–20 мкм, справедливо следующее соотношение [2]:
 =
= 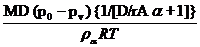 , (27)
, (27)
где А=(RT/2М)1/2; a – коэффициент конденсации или испарения, определяющий, какая доля всех молекул, ударяющихся о поверхность, конденсируется.
Для расчета скоростей испарения можно также использовать все приведенные выше уравнения, но при этом необходимо изменить знак на противоположный.
Контрольные вопросы
1. Объясните физический смысл явления седиментации аэрозольных частиц в газовой среде.
2. Сущность процесса коагуляции аэрозольных частиц в газовой среде; броуновская коагуляция.
3. Процесс коагуляции частиц в ламинарном потоке газа.
4. Объясните процесс коагуляции аэрозольных частиц в турбулентном потоке газа.
5. Объясните механизмы коагуляции электрически заряженных частиц
6. Физическая сущность процессов конденсации и испарения в газовой среде.
Не нашли, что искали? Воспользуйтесь поиском: