
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Приготовление инокулюма из бульонной культуры
При определении чувствительности быстро растущих бактерий с обычными питательными потребностями для приготовления инокулюма также можно использовать 5-6-часовую бульонную культуру микроорганизма. Для этого отбирают несколько однотипных изолированных колоний, петлей переносят незначительное количество материала в пробирку с 4,0-5,0 мл жидкой неселективной питательной среды. Инкубируют при 35° С. Через 5-6 ч инкубации плотность микробной суспензии приблизительно соответствует необходимой, и ее точно доводят до 0,5 по МакФарланду путем добавления стерильного бульона или физраствора.
Стандарт МакФарланда может быть либо приобретен, либо приготовлен в лаборатории.
Метод серийных разведений. Методом серийных разведений МИК определяют по минимальной концентрации антибиотика, задерживающей видимый рост микроба в пробирках или чашках с питательной средой, содержащих убывающие концентрации антибиотика. Например, для определения МИК тетрациклина в отношении культуры Staphylococcus aureus, выделенной от больного, в ряду пробирок готовят двукратно убывающие концентрации этого антибиотика в стандартном питательном бульоне, для чего содержимое пробирки перемешивается и переносится 1 мл из 2-я
пробирки в 3-ю, из 3-й - в 4-ю и т.д., а из последней пробирки
1 мл удаляется.
Таблица 1
| Ингредиенты | Номер опытной пробирки (конечная концентрация антибиотика), мкг/мл | Контроль | |||||||
| 1 (64) | (32) | (16) | (8) | (4) | культуры | бульона | антибиотика | ||
| Бульон, мл | - | - | |||||||
| Раствор антибиотика (64 мкг/мл), мл | - | - | - | - | - | ||||
| Испытуемая культура (стандартизованная суспензия) | - | - | |||||||
| Инкубирование в оптимальных для культуры условиях 18-24 ч | |||||||||
| Пример учета | - | - | - | + | + | + | - | - | |
| Интерпретация результата: МИК тетрациклина в отношении испытуемой культуры - 16 мкг/мл | |||||||||
Определение чувствительности микроорганизмов к антибиотикам (МИК, мкг/мл) методом серийных разведений в бульоне
Учетным признаком при этом является наличие/отсутствие мутности бульона в пробирках. В контроле культуры должна быть мутность, в остальных контролях - нет. Величина МИК соответствует той минимальной концентрации, при которой отсутствует мутность (бульон в пробирке прозрачен). Так, если бульон будет мутным в 4-й и 5-й опытных пробирках, МИК тетрациклина = 16 мкг/мл Известно, что величина К тетрациклина при введении среднетерапевтических доз — 2 мкг/мл (при использовании максимальных доз — 10 мкг/мл). Следовательно, в данном случае терапевтический индекс будет равен Т = 16/2 = 8 (> 0,3), т.е. возбудитель устойчив к антибиотику и лечение тетрациклином не даст антимикробного эффекта в отношении Staphylococcus aureus у данного больного даже при введении максимальных доз (Т = 16/10 =1,6 Метод серийных разведений считается наиболее точным, но относительно трудоемким.
Диско-диффузионный метод (ДДМ)
Принцип метода. ДДМ определения чувствиельности основан на способности АБП диффундировать из пропитанных ими бумажных дисков в питательную среду, угнетая рост микроорганизмов, посеянных на поверхности агара.
Питательная среда. Для определения чувствительности ДДМ используют такую же, как и для метода разведений в агаре, питательную среду. К качеству питательных сред для постановки диско-диффузионного метода выдвигаются те же требования, что и к плотным питательным средам для постановки метода серийных разведений в агаре, соответственно используются и те же методы контроля качества.
Приготовление чашек Петри с плотной питательной средой связано с некоторыми особенностями. Плотную питательную среду готовят в соответствии с инструкцией изготовителя. Важным моментом при определении чувствительности ДДМ является толщина слоя агара в чашке. Она должна составлять 4,0+0,5 мм, что достигается при внесении в чашку Петри диаметром 90 мм строго 20 мл агара, диаметром 100 мм - 25 мл агара, а диаметром 150 мм - 60 мл агара. Перед заполнением расплавленной средой чашки Петри устанавливают на строго горизонтальную поверхность (выверенную по уровню, без впадин и выпуклостей). Соблюдение указанных предосторожностей необходимо в связи с тем, что размер и форма зоны подавления роста зависят от глубины и равномерности агарового слоя.
После заполнения чашки оставляют при комнатной температуре для застывания. Хранить чашки можно запаянными в полиэтиленовые пакеты при 4-8 °С в течение 7-10 сут. При использовании свежеприготовленных чашек или чашек после хранения в холодильнике их необходимо подсушить перед инокуляцией, что достигается инкубацией при 35 °С с приоткрытой крышкой в течение 10-20 мин. Перед инокуляцией необходимо проконтролировать отсутствие конденсата жидкости на внутренней поверхности крышек.
Диски с антибиотиками. Для определения чувствительности ДДМ следует использовать только стандартизированные качественные диски. Изготовление дисков с АБП, необходимых для определения чувствительности диско-диффузионным методом, в лабораторных условиях нецелесообразно. Это связано с жесткими требованиями к исходным материалам (субстанциям АБП, картону) и со значительной трудоемкостью методов контроля качества дисков.
Для получения правильных результатов определения чувствительности ДДМ необходимо строго соблюдать правила хранения и использования коммерческих дисков, в противном случае содержание в них антибиотиков может снизиться ниже допустимого уровня (прежде всего в результате увлажнения) еще до истечения срока годности.
Долговременное хранение дисков с АБП осуществляется в герметичной упаковке в морозильной камере при температуре -18 °С и ниже. Небольшие партии дисков, используемые в повседневной работе, можно хранить в холодильнике при температуре 4-8 °С, плотно укупоренными так, чтобы гарантировать невозможность попадания во флакон влаги, кроме того, для дополнительной защиты от влаги во флаконах (картриджах) с дисками коммерческого изготовления содержится специальный влагопоглотитель (силикагель).
Флаконы (картриджи) с дисками следует извлекать из холодильника за 1 ч до начала работы и выдерживать герметично закрытыми до достижения ими комнатной температуры, что предотвращает образование конденсата на дисках после открывания флаконов.
Стандартный инокулюм наносят пипеткой на поверхность чашки Петри с питательной средой в объеме 1-2 мл, равномерно распределяют по поверхности покачиванием, после чего удаляют избыток инокулюма пипеткой. Приоткрытые чашки подсушивают при комнатной температуре в течение 10-15 мин.
Аппликация дисков и инкубация. Не позднее, чем через 15 мин после инокуляции на поверхность питательной среды наносят диски с АБП. Аппликацию дисков проводят с помощью стерильного пинцета или автоматического диспенсера. Расстояние от диска до края чашки и между дисками должно быть 15-20 мм. Таким образом, на одну чашку диаметром 100 мм следует помещать не более 6 дисков с АБП. Диски должны равномерно контактировать с поверхностью агара, для чего их следует аккуратно прижать пинцетом.
Непосредственно после аппликации дисков чашки Петри помещают в термостат кверху дном и инкубируют при температуре 35 °С в течение 18-24 ч (в зависимости от вида тестируемого микроорганизма). Увеличение интервала времени между нанесением дисков на поверхность среды и началом инкубации (а соответственно - началом роста исследуемой культуры микроорганизма) приводит к «преддиффузии» АБП в агар и к увеличению диаметра зоны подавления роста.
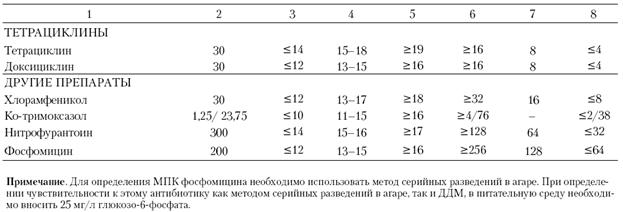
Учет результатов. После окончания инкубации чашки помещают кверху дном на темную матовую поверхность так, чтобы свет падал на них под углом в 45° (учет в отраженном свете). Диаметр зон задержки роста измеряют с точностью до 1 мм, предпочтительнее пользоваться штангенциркулем или кронциркулем (Таблица 2).
При измерении зон задержки роста следует ориентироваться на зону полного подавления видимого роста. Не следует обращать внимания на очень мелкие колонии, выявляемые в пределах зоны задержки роста только при особых условиях освещения или увеличении, и едва заметный налет у края зоны. Исключение составляют случаи учета результатов определения чувствительности стафилококков к оксациллину, когда необходимо учитывать и самые мелкие колонии, выявляемые в пределах четкой зоны подавления роста.
Крупные колонии, выявляемые в пределах четкой зоны подавления роста, свидетельствуют о наличии посторонней микрофлоры или о гетерорезистентности популяции микроорганизмов, в этом случае необходимо повторить идентификацию микроорганизма, формирующего эту колонию, и определение чувствительности этого штамма.
При определении чувствительности ДДМ роящихся штаммов протея, зона подавления роста может быть затянута тонкой вуалеобразной пленкой, которая не мешает установлению границы зоны и не учитывается при регистрации результатов.
При определении чувствительности к сульфаниламидам и их комбинации с триметопримом границу зоны подавления роста следует учитывать на уровне подавления роста на 80%. Это связано с тем, что под действием этих препаратов перед полным подавлением роста возможно завершение 1-2 циклов пролиферации микроорганизма Другие методы. Промежуточное положение между двумя вышеописанными методами занимает метод определения чувствительности с помощью Е-тестов. Последние представляют собой бумажные полоски, пропитанные не одной, а рядом убывающих концентраций определенного антибиотика (128, 64, 32, 16, 8, 4,…., мкг/мл). Е-тесты, как и диски при диско-диффузионном методе, укладывают на поверхность стандартного питательного агара, засеянного испытуемой культурой в виде «газона». После инкубирования вокруг полоски формируется эллипсовидная зона задержки роста, которая сужается в области малых концентраций и «пересекает» полоску на уровне, соответствующем величине МИК (рисунок 1).
|
|
|




При массовых исследованиях используют автоматизированные методы определения чувствительности к антибиотикам. Это позволяет упростить и ускорить проведение исследования, а также снизить его стоимость. Наиболее часто применяют методы серийных разведений в планшетах и пограничных концентраций (микрометоды). В первом случае, как правило, используют готовые стерильные полистироловые 96-луночные планшеты, в лунки которых внесены и лиофильно высушены убывающие концентрации антибиотиков в бульоне. После вскрытия планшета стандартизованную суспензию испытуемой культуры в одинаковой дозе (например, 0,1 мл) асептически вносят в соответствующие ряды лунок, закрывают крышкой и инкубируют при оптимальной температуре. Среда при этом восстанавливается, что позволяет после инкубирования планшета отметить рост (помутнение бульона) в тех лунках, где антибиотик не действует (Рисунок 2) При помутнении бульона в контроле культуры и опытных лунках определяют величину МИК. Учет можно вести как визуально, так и с помощью специальных микробиологических анализаторов. В этих приборах имеется возможность автоматизации основных действий: внесения культуры, инкубирования, встряхивания, определения оптической плотности (степени мутности) жидкости в каждой лунке, графическое отображение результатов (в том числе в динамике), определение степени чувствительности и печать протокола исследования.
Метод пограничных концентраций можно считать усеченным методом серийных разведений. В соответствии с ним испытуемую культуру вносят только в две лунки (пробирки), где находятся высокая (С) и низкая (с) концентрации антибиотика. Концентрация С соответствует границе между устойчивыми и умеренно устойчивыми штаммами, а концентрация с — границе между умеренно устойчивыми и чувствительными штаммами. Если после инкубирования рост отсутствует в обеих лунках, штамм относят к чувствительным, если только в лунке с концентрацией С - к умеренно устойчивыми штаммам, а если в обеих лунках имеется рост, штамм относят к устойчивым.
Важными условиями корректного определения чувствительности микроорганизмов к антибиотикам являются:
Ø использование только чистых культур и соблюдение правил асептики;
Ø применение стандартных питательных сред, соответствующих
питательным потребностям испытуемого микроорганизма (среда)
Мюллера — Хинтона, агар АГВ, среда НТМ и др.);
Ø внесение испытуемой культуры в стандартной дозе и соблюдение установленного соотношения инокулюм/среда;
Ø правильный режим инкубирования и метод учета.
Учитывая то, что признак подвержен фенотипическим и генотипическим изменениям, чувствительность к антибиотикам желательно проверять у свежевыделенных культур, выделенных из материала до начала антибиотикотерапии, и повторять исследование с культурами, выделенными в ходе лечения.

|
В последние годы в практике стали применять ПЦР для выявления у микробов специфических генов, ответственных за формирование лекарственной устойчивости (геноиндикация антибиотикоустойчивых культур).
Задание:
Определить чувствительность культур E. coli и S. aureus диско-диффузионным методом.
Методика:
Ø Отобрать несколько однотипных изолированных колоний, петлей перенести незначительное количество материала в пробирку с 4,0-5,0 мл жидкой неселективной питательной среды. Инкубировать при 35° С. Через 5-6 ч инкубации плотность микробной суспензии приблизительно соответствует необходимой, и ее точно довести до 0,5 по МакФарланду путем добавления стерильного бульона или физраствора.
Ø Стандартный инокулюм нанести пипеткой на поверхность чашки Петри с питательной средой в объеме 1-2 мл, равномерно распределяя по поверхности покачиванием, после чего удалить избыток инокулюма пипеткой. Приоткрытые чашки подсушить при комнатной температуре в течение 10-15 мин
Ø Через 15 мин после инокуляции на поверхность питательной среды нанести диски с АБП. Аппликацию дисков проводят с помощью стерильного пинцета или автоматического диспенсера. Расстояние от диска до края чашки и между дисками должно быть 15-20 мм. Таким образом, на одну чашку диаметром 100 мм следует помещать не более 6 дисков с АБП
Ø Непосредственно после аппликации дисков чашки Петри поместить в термостат кверху дном и инкубировать при температуре 35 °С в течение 18-24 ч
Ø Учесть результаты, измерив зоны задержки роста линейкой и определить устойчивость, пользуясь таблицей 2
Ø Результаты и ход исследования занести в тетрадь
СКР
1. Дайте определение минимальной ингибирующей концентрации антибиотика.
2. Что такое терапевтический индекс?
3. Какой из методов определения чувствительности к антибиотикам наиболее точный?
4. Что такое Е-тесты?
ЛИТЕРАТУРА
Основная
1. Борисов Л.Б. Медицинская микробиология, вирусология, иммунология. М.: Медицинское информационное агентство, 2005 г.
- Медицинская микробиология. Гл. редакторы акад. РАМН В.И. Покровский, проф. О.К. Поздеев М.: ГЭОТАР Медицина, 1999 г.
- Медицинская микробиология, вирусология, иммунология. Под редакцией академика РАМН А.А.Воробьева. Москва,2008. – 704 с.
Дополнительная
1. Медицинская микробиология. Учебное пособие Под редакцией А. М. Королюка и В. Б. Сбойчакова. Санкт_Петербург, ЭЛБИ-Спб, 2002 г.
2. Павлович С.А. Основы вирусологии. Минск, Вышэйшая школа, 2001 г.
3. Медицинская микробиология Алешукина А.В.
СОДЕРЖАНИЕ
| Пояснительная записка | |
| Введение | |
| РАЗДЕЛ 1. СИСТЕМАТИКА МИКРОООРГАНИЗМОВ | |
| РАЗДЕЛ 2. МОРФОЛОГИЯ И УЛЬТРАСТУРКТУРА МИКРОООРГАНИЗМОВ | |
| Лабораторное занятие № 1. Микроскопические методы исследования в микробиологии. Техника безопасности работы в учебной лаборатории. Световая и электронная микроскопия | |
| Лабораторное занятие № 2. Микроскопические методы исследования в микробиологии (продолжение) Правила работы с культурами микроорганизмов. Методы изучения бактерий в фиксированных окрашенных препаратах | |
| Лабораторное занятие № 3. Микроскопические методы исследования в микробиологии (продолжение) Методы окраски кислотоустойчивых и спороообразующих микроорганизмов | |
| Лабораторное занятие № 4. Микроскопические методы исследования в микробиологии (продолжение) Методы окраски капсулы и включений бактерий | |
| РАЗДЕЛ 3. ФИЗИОЛОГИЯ И БИОХИМИЯ МИКРООРГАНИЗМОВ | |
| Лабораторное занятие № 5. Культуральный метод исследования в микробиологии. Питательные среды. Культивирование микроорганизмов | |
| Лабораторное занятие №6. Дезинфекция, асептика, антисептика | |
| Лабораторное занятие № 7. Культуральный метод исследования в микробиологии (продолжение) Выделение чистой культуры аэробов (1 и 2 этап) | |
| Лабораторное занятие № 8. Культуральный метод исследования в микробиологии (продолжение) Выделение чистой культуры аэробов (3 этап). Выделение чистой культуры анаэробов (1 этап) | |
| Лабораторное занятие № 9. Культуральный метод исследования в микробиологии (продолжение) Выделение чистой культуры анаэробов (2 и 3 этап) | |
| РАЗДЕЛ 4. ГЕНЕТИКА МИКРООРГАНИЗМОВ | |
| Лабораторное занятие № 12. Методы генной инженерии, Трансформация плазмидной ДНК | |
| РАЗДЕЛ 5. ИНФЕКЦИЯ И МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ ОСНОВЫ ВИРУЛЕНТНОСТИ МИКРОБОВ | |
| Лабораторное занятие №13. Применение лабораторных животных для биологических методов исследования | |
| РАЗДЕЛ 6. РАСПРОСТРАНЕНИЕ МИКРООРГАНИЗМОВ В ПРИРОДЕ И МИКРОФЛОРА ТЕЛА ЧЕЛОВЕКА. САНИТАРНАЯ МИКРОБИОЛОГИЯ | |
| Лабораторное занятие №14. Методы санитарной микробиологии | |
| РАЗДЕЛ 7. ОСНОВЫ ХИМИОПРОФИЛАКТИКИ И ХИМИОТЕРАПИИ | |
| Лабораторное занятие №15. Методы определения чувствительности микроорганизмов к антибиотикам | |
| РАЗДЕЛ 8. ОСНОВЫ ИНФЕКЦИОННОЙ ИММУНОЛОГИИ | |
| Лабораторное занятие №16. Иммунодиагностические реакции. (реакция агглютинации, реакция непрямой гемагглютинации, реакция непрямой суспензионной агглютинации латексов) | |
| Лабораторное занятие №17. Иммунодиагностические реакции (иммуноферментный анализ, реакция преципитации, реакции иммунодиффузии, реакция флокуляции) | |
| ЛИТЕРАТУРА |
Не нашли, что искали? Воспользуйтесь поиском: