
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Загальна характеристика 3 страница
Три амінокислоти - аргінін, гліцин і метіонін - беруть участь у синтезі креатину - сполуки, за допомогою якого в м'язовій тканині відбувається безперервний ресинтез макроерга АТФ (аденозинтрифосфорної кислоти).
При участі креатину в організмі людини і тварин утворюється креатин- фосфат, що у міру необхідності віддає свою фосфатну групу молекулам АДФ, перетворюючись в креатинін:

Креатин і циклічний креатинін входять до складу м'ясного екстракту, їхнє співвідношення залежить від рН середовища і температури. Так, при нагріванні м'яса в кислому середовищі в екстракті переважає креатинін.
Амінокислоти цитруллін і орнітин беруть участь разом з аргініном у циклі утворення сечовини в людини і тварин.
Фундаментальну роль в обміні речовин живих організмів грають глутамінова і аспарагінова кислоти. Вони беруть участь у процесах розщеплення, синтезу і переносу активних груп, часто у формі амідів.
Глутамін, наприклад, є основною формою переносу аміаку в крові людини і разом з аспарагіновою кислотою служить попередником пиримідинового кільця нуклеотидів.
Реакції декарбоксилювання глутамінової кислоти з утворенням g-аміномасляної кислоти, що відноситься до групи медіаторів центральної нервової системи, приділяється важлива роль в обміні речовин у мозку і нервовій тканині.
З обміном глутамінової кислоти тісно зв'язаний обмін проліну, що синтезується з неї в результаті відновлення проліндегідрогеназою. Пролін відіграє важливу роль у формуванні структури колагену і білків пшеничної клейковини, викликаючи вигини в поліпептидних ланцюгах.
У колагені, поряд із проліном, зустрічаються 4-оксипролін і 5-оксилізин, що утворюються за рахунок окиснювання відповідних амінокислот вже після включення в білок. Присутність оксипроліну в м'ясних і ковбасних виробах впливає на їхню якість і враховується при її оцінці.
Основна фізіологічна роль іншої сірковмісної амінокислоти - метіоніну зв'язана з наявністю лабільної метильної групи. Віддаючи групу -СН3 метіонін бере участь у синтезі гліцерофосфоліпідів. Фізіологічна роль амінокислоти серин полягає в тому, що у великій кількості входить до складу складних білків - фосфопротеїдів (казеїну молока і вітелліну яйця).
Серин, у свою чергу, синтезується з гліцину під дією ферменту, що містить тетрагідрофолієву кислоту (ТГФК).
Незамінна амінокислота триптофан служить попередником нікотинової кислоти, серотоніну і індолілоцтової кислоти - гормону росту рослин. Серотонін, володіючи судинозвужувальною дією, синтезується в клітинах кишечнику і нервової тканини.
Тирозин є відповідальним за пігментацію волосся, шкіри, очей, за темний колір харчових продуктів (наприклад, житнього хліба), тому що з його участю синтезуються темнозабарвлені пігменти - меланіни. Механізм реакції до кінця не вивчений, але відомі перші етапи їхнього синтезу. Під дією мідьвмісного ферменту тирозин перетворюється в диоксифенілаланін (ДОФА), що далі окиснюється, циклізується, утворюється індолхінон. Полімеризація останнього приводить до синтезу меланинів.
Утворення меланинів підсилюється під впливом ультрафіолетових променів (при засмазі) і може бути причиною злоякісних новоутворень. При спадкоємному захворюванні - альбінізмі, що характеризується відсутністю ферменту тирозинази, навпаки, не спостерігається пігментація шкіри, волосся. Тирозин утворюється з фенілаланіну.
З тирозину і триптофану, що містяться в їжі, при участі мікробних ферментів у кишечнику утворюються отрутні продукти - крезол, фенол, скатол, індол, знешкодження яких відбувається в печінці шляхом зв'язування із сірчаною або глюкуроновою кислотою з утворенням нетоксичних (парних) кислот, наприклад, фенол-сірчаної кислоти.
У результаті декарбоксилювання амінокислот в організмі утворюються деякі важливі біогенні аміни. Декарбоксилювання аспарагінової кислоти забезпечує синтез аланіну, що є складовою частиною біологічно активних сполук – КоА й АПБ, а декарбоксилювання лізину й орнітину під впливом ферментів кишкової мікрофлори призводить до утворення отрутних діамінів - кадаверину і путресцину. У здоровому організмі обидва аміни цілком знешкоджуються в слизуватій оболонці кишечнику.
Частина амінокислот виконує роль медіаторів - речовин, що беруть участь у передачі нервових імпульсів від однієї нервової клітини до іншої. При роздратуванні нервових волокон медіатори реагують зі специфічним рецептором і забезпечують відповідну фізіологічну функцію: регуляцію сну, пильнування, серцево-судинну діяльність, терморегуляцію тіла. До медіаторів відносяться ацетилхолін, глютамінова і аспарагінова кислоти, гліцин, гістамін, серотонін, норадреналін та інші.
Таким чином, наведені відомості показують, яку велику роль грають амінокислоти в синтезі найважливіших фізіологічно активних сполук в організмі і забезпеченні деяких властивостей харчової сировини і продуктів.
Майже усі a-амінокислоти, що надходять із травного тракту людини в кров'яне русло організму, перетерплюють ряд загальних перетворень, призначення яких полягає в забезпеченні пластичним матеріалом процесів синтезу білків і пептидів.
2.4. БУДОВА Й СТРУКТУРНА ОРГАНІЗАЦІЯ БІЛКОВОЇ МОЛЕКУЛИ
Поліпептидна будова білків
Амінокислоти приєднані одна до одної ковалентним амідним зв'язком, що виникає при взаємодії a-карбоксильної групи однієї амінокислоти з a-аміногрупою іншої амінокислоти. При цьому виділяється вода. Продукти такої реакції називаються пептидами, а сам зв'язок між амінокислотами отримав назву пептидного.

У пептидів на одному кінці - вільна аміногрупа, а на іншому - карбоксильна. До цих груп можуть приєднуватися нові амінокислоти, завдяки чому відбувається нарощування пептидного ланцюга.
За числом амінокислотних залишків розрізняють дипептиди, трипептиди, тетрапептиди і т.п. Пептиди, що містять від двох до десяти залишків, називаються олігопептидами. Пептиди, що складаються більш ніж з десяти залишків амінокислот, відносяться до поліпептидів.
Початком поліпептидного ланцюга прийнято вважати амінокислоту з вільною a -аміногрупою (N - кінцева амінокислота), кінцем - амінокислоту з вільною карбоксильною групою (С - кінцева амінокислота). Найменування пептидів складається з назви першої амінокислоти з типовим для ацилів закінченням -іл, назв наступних амінокислот (також із закінченням -іл) і повної назви останньої амінокислоти (закінчення не змінюється). Наприклад, зображений нижче тетрапептид називається гліцил-аргініл-глутаміл-аланін, або скорочено Глі-Арг-Глу-Ала.
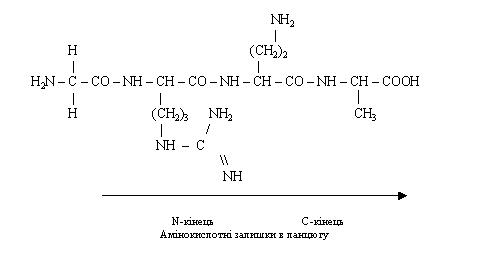
Типи хімічних зв'язків у білковій молекулі
У біомолекулах хімічні зв'язки можна розділити на ковалентні і нековалентні. До ковалентних відносяться пептидний і дисульфідний зв'язки. Важливу роль у підтримці просторової структури біологічних молекул грають більш слабкі, чим ковалентні, хімічні зв'язки (водневі, гідрофобні взаємодії, ван-дер-ваальсові сили, іонні зв'язки).
Водневі зв'язки. Цей тип зв'язку з'являється при електростатичній взаємодії атома гідрогену з частково позитивним зарядом і ковалентно зв'язаного атома оксигену (нітрогену) з негативним зарядом. Здатність до утворення водневих зв'язків яскраво виражена в сполуках, що містять групи -СО, -NH, -ОН, -COO-, -СОН. Молекули білків можуть мати водневі зв'язки різних типів.
У білковій молекулі водневі зв'язки можуть утворюватися між угрупованнями пептидних ланцюгів і бічних ланцюгів амінокислот. Водневі зв'язки бувають внутрімолекулярними і міжмолекулярними. Одиничний водневий зв'язок досить слабкий і неміцний, однак утворення навіть декількох таких зв'язків, що діють кооперативно, являє собою стабілізуючий фактор.
Гідрофобні взаємодії. Сполуки, що несуть заряди, а також здатні до утворення водневих зв'язків, є полярними, або гідрофільними (від грец. hydor - вода і phіlіa - любов). Внаслідок того, що електронегативний заряд карбогену близький до гідрогену, карбоген не здатний до утворення водневих зв'язків. Зв'язки С-Н неполярні, тому вуглеводневі ланцюги гідрофобні (від грец. hydor - вода і phobos - острах). Молекули води, прагнучи утворити між собою водневі зв'язки, виштовхують гідрофобні групи і молекули, змушуючи їх перетворюватися в асоціати. Цей процес йде мимовільно. Гідрофобні асоціати мають першорядне значення для "архітектури" біомембран, нуклеїнових кислот і білків. У білках гідрофобні взаємодії виникають унаслідок прагнення неполярних гідрофобних бічних ланцюгів ряду амінокислот (Вал, Ала, Лей, Іле, Фен, Тир, Три) уникати контакту з водою. Поліпептидний ланцюг при цьому звертається як би в клубок, усередині якого зближаються гідрофобні угруповання, а на поверхні розташовуються полярні групи, взаємодіючі з водою.
Ван-дер-ваальсові сили. За своєю природою ці зв'язки нагадують водневі, тому що виникають на основі кулонівських сил електростатичного притягання. Однак, якщо в утворенні водневих зв'язків беруть участь постійні диполі високополярних ковалентних зв'язків, то ван-дер-ваальсові сили виникають при індукованих, непостійних диполях слабко полярних ковалентних зв'язків, наприклад С-Н. Незважаючи на те, що ван-дер-ваальсові сили дуже слабкі, вони фактично обумовлюють асоціацію багатьох неполярних угруповань у біомолекулах.
Іонні зв'язки. Даний тип заснований на взаємному електростатичному притяганні протилежно заряджених іонів. Прикладом такої взаємодії служить зв'язок між негативно зарядженою карбоксильною групою СОО- і позитивно зарядженою протонованою аміногрупою NH2+.
Найважливішою особливістю слабких хімічних зв'язків є те, що їхня енергія незначно перевищує кінетичну енергію теплового руху (2,5 кДж/моль). Цього невеликого перевищення виявляється досить, щоб виникли слабкі взаємодії як усередині, так і між біомолекулами. Такі неміцні вторинні хімічні зв'язки дуже лабильні, що обумовлює їхнє швидке виникнення і розпад.
Рівні організації білкової молекули
При розгляді структури білкової молекули прийнято розрізняти чотири рівні її організації: первинну, вторинну, третинну і четвертинну.
Первинна структура білка. Під первинною структурою розуміють число і послідовність амінокислотних залишків у поліпептидному ланцюзі (мал. 2.1). Вона визначається: 1) природою вхідних у білок амінокислот; 2) кількістю кожної амінокислоти; 3) строго визначеною амінокислотною послідовністю поліпептидного ланцюга.
Небілкові (простетичні) групи також включаються в первинну структуру білка. Основним типом хімічного зв'язку первинної структури є пептидний зв'язок. Ряд білків має невелике число дисульфідних зв'язків.
Кожен білок характеризується унікальною первинною структурою, обумовленою на генетичному рівні. В даний час установлено, що біологічна активність білка і його загальна конформація визначаються амінокислотною послідовністю. Заміна амінокислоти в поліпептидному ланцюзі може привести як до структурних змін молекул білка, так і до змін його фізико-хімічних властивостей і біологічних функцій.

Малюнок 2.1. Первинна структура рибонуклеази
Вторинна структура білка. Під вторинною структурою поліпептидного ланцюга розуміють упорядковане просторове розташування окремих її ділянок. У природних білках визначається два основних типи вторинної структури: a-спіраль і b-структура (складчасті шари). Основним хімічним зв'язком, що підтримує вторинну структуру, є водневий зв'язок. У a-спіралі диполі сусідніх пептидних зв'язків (кожна -С=О-група має водневий зв'язок з четвертою за ходом ланцюга -NH-групою) утворюють велику систему внутрімолекулярних кооперативних водневих зв'язків, що стабілізують спіральну конформацію поліпептидного ланцюга. Бічні ланцюги амінокислот у a-спіралі спрямовані назовні від центральної осі. b-структура також стабілізується кооперативними міжпептидними водневими зв'язками в межах окремих ділянок одного поліпептидного ланцюга (у глобулярних білках) або між суміжними ланцюгами (у фібрилярних білках).
У більшості природних білків високо структуровані ділянки ланцюга чергуються з ділянками без вираженої вторинної структури.
Третинна структура білка. Третинна структура поліпептидного ланцюга визначає характер укладання спіральних і лінійних ділянок у даному обсязі (мал. 2.2). Укладання ланцюга в просторі відбувається з великою точністю: той або інший поліпептидний ланцюг за певних умов згортаються тільки одним-єдиним способом, здобуваючи ту форму, що характерна для молекул даного нативного (природного) білка. Завдяки такій строгій закономірності білок може цілком виконувати своє функціональне призначення.

Малюнок 2.2 Схематичне зображення тримірної структури міоглобіну
Форма молекул білка буває різною: від кулястої до нитковидної; за цією ознакою білки поділяються на глобулярні і фібрилярні (нитковидні). У глобулярних - третинна структура характеризується досить щільним упакуванням ланцюга у виді клубка.
Четвертинна структура білка. Четвертинна структура характерна для тих білків, молекула яких складається з двох і більш поліпептидних ланцюгів (субодиниць). Причому найчастіше зустрічаються димери, тримери і тетрамери. Стабілізацію четвертинної структури забезпечують нековалентні взаємодії між амінокислотними залишками, розташованими поблизу поверхні кожної глобули. З білків такого типу найбільш вивчений гемоглобін (мал.2.3). Він є типовим представником білків, що мають четвертинну структуру. Його молекула побудована з чотирьох попарно однакових субодиниць – двох a - та двох b-поліпептидних ланцюгів, кожен з яких з’єднаний з небілковою сполукою гемом – порфіриновим похідним, що зв’язує молекулу оксигену.
Білки з четвертинною структурою можуть включати як однакові протомери (як у прикладі гемоглобіну), так і різні. У складі багатьох білків-ферментів містяться різні протомери, що виконують різні біохімічні функції (зокрема, каталітичну та регуляторну).
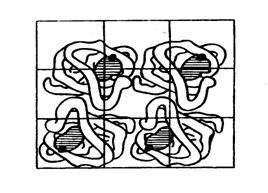
Малюнок 2.3. Четвертинна структура гемоглобіну
Молекула білка в четвертинній структурі - це взаємне просторове розташування глобул, що представляють собою єдине ціле в структурному і функціональному сенсі.
Четвертинній структурі належить важлива роль у регуляції біологічної активності білків, тому що вона дуже чуттєва до зовнішніх впливів, що викликають зміну взаєморозташування субодиниць і, як наслідок, - зміну активності білка. Таким чином, для кожного білка характерна своя просторова структура - конформація. У її формуванні ведуча роль належить первинній структурі, обумовленою інформацією, яка зберігається в ДНК. Нативні структуровані білкові молекули мають великий ступінь упорядкованості в порівнянні з розгорнутою поліпептидною ниткою. Спіралізація лінійного пептичного ланцюга (утворення вторинної структури) зменшує її розміри приблизно в 4 рази, а укладання в третинну структуру робить її в десятки разів більш компактною, ніж вихідний поліпептидний ланцюг.
Є домени - глобулярні утворення всередині білків із третинною структурою. Діаметр глобулярного домену дорівнює в середньому 2,5 нм; до його складу входить 100-150 амінокислотних залишків. Окремі домени є функціонально відносно автономними утвореннями в складі білкових молекул, і доменні білки в цьому відношенні подібні до олігомерних білків. Але, на відміну від білків із четвертинною структурою (олігомерів), окремі доменні глобули утворюються тим самим поліпептидним ланцюгом і, відповідно, зв’язані між собою пепетидними фрагментами (“шарнірними” ділянками). З’вязки між доменами можна розщепити тільки за допомогою протеолітичних ферментів.
Прикладами доменних білків є ферменти гліколітичного шляху окиснення глюкози, у складі яких окремі домени реалізують різні етапи складного каталітичного акту.
2.5. ФІЗИКО-ХІМІЧНІ ВЛАСТИВОСТІ БІЛКІВ
Амінокислотний склад і просторова організація кожного білка визначають його фізико-хімічні властивості. Найважливішою ознакою білків є їх велика молекулярна маса. Вона коливається від 6000 до декількох мільйонів.
Амфотерні властивості білків
Білки є амфотерними електролітами, тому що в їхніх молекулах присутні як кислотні, так і основні угруповання. Вплив a-аміно- і a-карбоксильних груп на кислотно-основні властивості білків незначний, тому що в молекулах білків вони беруть участь в утворенні пептидних зв'язків. Амфотерність білкам додають бічні залишки кислих і основних амінокислот. Присутність дисоціюючих -NH2- і -СООН-груп обумовлює визначений сумарний заряд білкової молекули, що залежить від рН середовища.
Природні білки в залежності від складу амінокислот можуть мати кислий або основний характер. У кислих білках переважають моноамінодикарбонові кислоти (Асп і Глу). Молекула такого білка в розчині заряджена негативно. Більшість білків відноситься до кислих, наприклад альбуміни, глобуліни, казеїн, пепсин і ін.
У молекулах білків основного характеру переважають диаміномонокарбонові кислоти (Лиз, Aрг, Гис). У розчині основні білки несуть позитивний заряд: серед цих білків - папаїн, трипсин, лізоцим і ін.
Сумарний заряд білкової молекули, природно, залежить від рН середовища: у кислому середовищі він позитивний, у лужному - негативний. Розподіл заряду на поверхні молекули нерівномірний, різні ділянки її можуть мати протилежні заряди, стабілізовані диполями води. Зрушення рН середовища призводить до зміни характеру дисоціації угруповань амінокислот, перерозподілу зарядів на поверхні молекул, що є причиною зміни просторової структури білка, отже, його біологічної активності.
Змінюючи рН середовища, можна впливати на константу дисоціації білкової молекули як кислотами, так і основами.
При визначеному для кожного білка значенні рН можна досягти такого стану, коли ступінь кислотної дисоціації стане рівним ступеню дисоціації білка як основи, тобто число негативних зарядів зрівнюється з числом позитивних. Заряд такої білкової молекули в цілому практично дорівнює нулю. Значення рН, при якому білок не несе сумарного заряду, називається ізоелектричною точкою.
Ізоелектрична точка є характерною константою білка і залежить від амінокислотного складу білкової молекули. Чим вище співвідношення кислі/основні амінокислоти в білку, тим нижче його рН. Для більшості внутрішньоклітинних білків рН знаходиться в області від 5,5 до 7,0, що свідчить про негативний заряд цитоплазми в цілому. Надлишок негативних зарядів усередині клітки врівноважується неорганічними катіонами.
Значення ізоелектричної точки дуже важливо для розуміння стабільності білків у розчинах, тому що в ній білки внаслідок електронейтральності найменш стійкі. Незаряджені частки білка можуть злипатися один з одним і випадати в осад.
Розчинність білків
Білки - гідрофільні речовини, тобто добре розчинні у воді. Під гідратацією розуміють зв'язування диполів води з іонними і полярними групами. Іонними групами в білках, що несуть заряд, є усі -NH2 і СООН -групи. У дисоційованому стані вони притягують молекули води за рахунок іон-дипольних взаємодій. Неіонні (незаряджені) полярні бічні угруповання амінокислот (-ОН, -NH, -С) утворюють з водою слабкі водневі зв'язки. Вода, зв'язана іонними групами, дуже міцно з'єднана з макромолекулою білка, відокремити її вдається з великими зусиллями. Молекули води, зв'язані з неіонними угрупованнями, білком утримуються менш міцно.
Стабільність розчинам білків додають заряд білкової молекули і гідратна оболонка. Кожна молекула білка має сумарний заряд одного знака, що перешкоджає агрегації молекул. Тому усі фактори, що сприяють збереженню заряду і гідратної оболонки, полегшують розчинність білка і його стійкість у розчині. Чим більше полярних амінокислот у білку, тим більше молекул води зв'язується. Гідратна вода може складати до 1/5 маси білка.
Розчинність білків у воді зростає при невеликих концентраціях нейтральних солей. Це пояснюється тим, що іони солей, взаємодіючи з протилежними зарядами в білку, екранують заряджені групи білкових молекул і тим самим зменшують білкову взаємодію.
Підвищення концентрації нейтральних солей (збільшення іонної сили розчину) робить зворотну дію. Процес осадження білків нейтральними солями називається висолюванням. При великих концентраціях іонів у розчині вони відтягають молекули води від полярних груп білка на себе. При цьому гідратна оболонка білкової молекули частково знімається, тобто порушується один з факторів стійкості білка в розчині. Можливо, одночасно відбувається нейтралізація зарядів білка іонами солей, що призводить до зміни другого фактора стійкості (зміні заряду білка в цілому), а отже, осадженню білка з розчину. Характерною рисою білків, отриманих при висолюванні, є збереження ними своїх природних властивостей і функцій після видалення солі.
Розчинність білків залежить і від розчинника: його рН, складу і температури. Додавання до білкового розчину органічних розчинників, що змішуються з водою, (етанолу, ацетону й ін.) зменшує розчинність білків. При високих концентраціях розчинників спостерігається випадання білка в осад (у зв'язку зі зменшенням ступеня гідратації білка).
У розчинах білки мають колоїдні властивості: вони повільно дифундують, не здатні проникати через напівпроникні мембрани, розсіюють світло, характеризуються високою в'язкістю.
Утворення колоїдних розчинів білками обумовлює багато фізико-хімічних явищ, що спостерігаються в біологічних рідинах і організмах у цілому. За певних умов усі колоїдні розчини можуть втрачати плинність і утворювати гелі (драглі). Вони виникають у результаті об'єднання молекул у виді сітки, внутрішній простір якої заповнено великою кількістю розчинника, але при цьому поділу на рідку і тверду фази не відбувається, як у випадку коагуляції. У клітинах живих організмів білки знаходяться не тільки у виді розчинів, але і гелів (у протоплазмі, кристалику ока, сполучних тканинах і ін.). Гелеутворенню легше піддаються фібрилярні білки. Так, харчові драглі готують із продуктів, що містять у великій кількості фібрилярні білки (кістки, хрящі, м'ясо). Під дією ферментів мікроорганізмів білковий розчин - молоко може переходити в гель з утворенням кефіру, кисляку.
Білкові гелі мають важливе фізіологічне значення в життєдіяльності організму. Наприклад, колагенові білки кісток, сухожиль, шкіри мають високу міцність, еластичність і пружність, тому що знаходяться в гелеподібному стані. Відкладення мінеральних солей при старінні знижує їхню пружність і еластичність, що призводить до ряду захворювань.
Однією із властивостей гелів є їхня здатність до набрякання - збільшення обсягу за рахунок зв'язування великої кількості води. Такий процес спостерігається при проростанні насіння, при замочуванні крупи, при виготовленні тесту і т.д.
Явище зворотнє набряканню (відділення води від гелю) називається синерезисом. Воно протікає, наприклад, при тривалому збереженні кефіру.
Завдяки наявності гідрофільних і гідрофобних груп білки можуть впливати на розчинність інших речовин, виступаючи в ролі емульгаторів. Відомо, що емульгаторами є речовини, що стабілізують емульсії типу "вода - олія". В організмі людини в емульгованому стані знаходяться жири в крові і лімфі. Білок утворює на поверхні крапельок жиру (за рахунок гідрофобних взаємодій) тонку плівку, що притягує воду (за рахунок полярних груп) і перешкоджає злипанню жирових часток. Казеїн молока можна розглядати як емульгатор, що стабілізує природну емульсію - молоко.
Денатурація білків
Під дією різних факторів нативна просторова структура білкової молекули може порушуватися: руйнуються четвертинна, третинна і вторинна структури (зміни не торкаються первинної структури). Це явище називається денатурацією. Денатурація білка призводить до зменшення або повної втрати розчинності, втрати специфічної біологічної активності, зміні оптичних властивостей і в'язкості та ін. При денатурації розриваються зв'язки, що стабілізують структуру білкової молекули: іонні, водневі і дисульфідні, порушується гідрофобна взаємодія. Поліпептидний ланцюг розкручується і знаходиться в розчині в розгорнутому стані або у виді “безладного” клубка. Ступінь денатурації білка може бути різною в залежності від його фізико-хімічних властивостей, природи денатуруючого агента і часу його дії. Для деяких білків денатурація зворотня (білки м'язів). При цьому і нативна конформація і біологічна активність білка можуть бути відновлені (при дотриманні визначених умов).
Денатуруючі фактори можна розділити на фізичні і хімічні. До фізичних агентів відносяться: температура, тиск, механічний вплив, ультразвукове й іонізуюче випромінювання. Найбільш загальним фактором є нагрівання. Теплова денатурація білків - одна з характерних їхніх ознак. Посилення теплового руху атомів поліпептидного ланцюга приводить до розриву слабких нековалентних зв'язків. Швидкість теплової денатурації істотно залежить від рН середовища, іонної сили розчину. Теплова денатурація супроводжується агрегацією білків, випаданням їх в осад. Найбільш повне і швидке осадження відбувається в ізоелектричній точці.
Білки денатурують при розтиранні сухих препаратів, енергійному струшуванні розчинів, збиванні і т.д. При ліофілізації білків (висушування у вакуумі шляхом сублімації вологи з замороженого стану) більшість їх не денатурує, що дозволяє використовувати цей спосіб сушіння для тривалого збереження білкових препаратів.
До хімічних факторів, що викликають денатурацію, відносяться кислоти, луги, органічні розчинники, поверхнево-активні речовини, алкалоїди, важкі метали і т.п.
2.6. КЛАСИФІКАЦІЯ Й ХАРАКТЕРИСТИКА БІЛКІВ
У залежності від хімічного складу білки поділяються на дві групи: прості і складні. Прості білки складаються тільки з амінокислот. У складні білки, крім амінокислот, входять небілкові компоненти, що називають простетичною групою. У свою чергу усередині кожної з цих груп білки підрозділяються на підгрупи. Прості білки умовно класифікують відповідно до їх розчинності в різних речовинах, а складні білки поділяють на основі хімічної природи небілкової частини молекул.
Прості білки
До простих білків відносяться альбуміни, глобуліни, проламіни, глютеліни, протаміни, гістони, протеїноїди.
Альбуміни. Білки цієї підгрупи мають невелику молекулярну масу (15000-70000 Да); їх відносять до кислих білків через великий вміст глутамінової кислоти. Альбуміни сильно гідратовані, вони добре розчиняються у воді; з водних розчинів осаджуються при насиченні нейтральними солями, наприклад сульфатом амонію. Альбуміни мають високу адсорбційну здатність. Так, альбуміни плазми крові завдяки неспецифічній адсорбції різних речовин виконують фізіологічно важливу транспортну функцію.
Альбуміни широко поширені в природі. У плазмі крові людини, курячих яйцях вони складають до 50 % усіх білків. Багаті альбумінами молоко і молочні продукти.
Глобуліни. Ці білки більші, ніж альбуміни; їхня молекулярна маса перевищує 100 000 Да. Глобуліни розчиняються в слабких розчинах різних солей (у воді нерозчинні). При 50-процентному насиченні розчину сульфатом амонію випадають в осад. Глобуліни є слабкокислими і нейтральними білками. Вони складають велику частину білків насіння, особливо бобових і олійних культур. Багато глобулінів у крові і інших біологічних рідинах.
Проламіни. Білки, добре розчинні в 70-процентному етанолі. Проламіни нерозчинні у воді і сольових розчинах. У своєму складі містять багато проліну і глутамінової кислоти. Проламіни є в злаках, де вони виконують роль запасних речовин. Кожний з них має специфічну назву по тому джерелу, з якого вони були виділені: гліадин - білок пшениці і жита, гордеїн - ячменя, зеїн - кукурудзи.
Глютеліни. Це білки рослин, нерозчинні у воді, розчинах солей, етиловому спирті. Вони добре розчиняються в слабких лугах (0,2-2 %). Глютеліни містять більше аргініну і менше проліну, ніж проламіни. Комплекс лугорозчинних білків насінь пшениці називається глютеніном, рису - оризеніном.
Фракційний склад білків зерна обумовлює технологічні властивості пшеничного, житнього, кукурудзяного, вівсяного борошна і різних круп. Білки пшениці добре набухають і утворюють в'язку еластичну масу - клейковину, основну частину якої складають гліадин і глютенін. Менш еластична, хоча і густа маса виходить з білків ячменя. Білкові речовини кукурудзи, вівса, рису, гречки слабко набухають і не здатні утворювати грузле тісто.
Протаміни. Це низькомолекулярні білки (молекулярна маса до 12 000 Да), що містять до 80 % основних амінокислот, головним чином аргініну. Отже, протаміни мають різко виражені основні властивості, розчинні в слабких кислотах. Молекули цих білків являють собою полівалентний катіон і легко реагують з негативно зарядженими речовинами, наприклад нуклеїновими кислотами.
Не нашли, что искали? Воспользуйтесь поиском: