
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Загальна характеристика 6 страница
| o | а) вуглеводів (пентоз), ліпідів, нуклеїнових основ, сульфату |
| o | б) вуглеводів (пентоз), нуклеїнових основ, сульфату, аміносахарів |
| o | в) нуклеїнових основ, вуглеводів (пентоз), фн. |
| o | г) нуклеїнових основ, вуглеводів (пентоз або гексоз), фн. |
3. Чим відрізняються мононуклеотиди ДНК від РНК?
| o | а) основами і вуглеводами |
| o | б) вуглеводом |
| o | в) одним із чотирьох основ і пентозою |
| o | г) основами. |
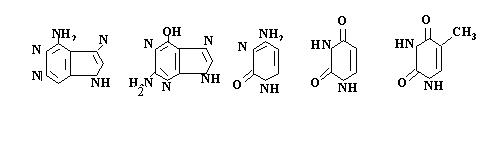
4. Які азотисті основи мають такі формули?
| o | а) А, Г, Т, У, Ц |
| o | б)А, Г, Ц, У, Т |
| o | в) А, Ц, Г, У, Т |
| o | г) Г, А, У, Т, Ц |
5. Які азотисті основи входять до складу ДНК?
| o | а)А, Г, Ц, Т |
| o | б) А, Г, Ц, У |
| o | в) Г, Ц, У, Т |
| o | г) А, Ц, У, Т |
6. Які азотисті основи входять до складу РНК?
| o | а) А, Г, У, Т |
| o | б) А, Г, Ц, Т |
| o | в) А, У, Ц, Т |
| o | г) А, Г, Ц, У |
6. Який вуглевод міститься в складі ДНК?
| o | а) глюкоза |
| o | б) рибоза |
| o | в) дезоксирибоза |
| o | г) фруктоза |
7. Який вуглевод міститься в складі РНК?
| o | а) глюкоза |
| o | б) рибоза |
| o | в) дезоксирибоза |
| o | г) фруктоза |
8. Що таке мінорні основи в складі НК?
| o | а) основи, що входять в НК рідко, порівняно з А,Г,Ц,Т,У |
| o | б) основи, що трапляються лише в НК нижчих організмів |
| o | в) основи, що трапляються тільки в НК вищих організмів і людини |
| o | г) основи, що трапляються тільки в НК вищих організмів людини |
9. Що таке мононуклеотиди (нуклеотиди), або мононуклеінові кислоти?
| o | а) продукти неповного гідролізу НК |
| o | б) мономери, що входять до складу полінуклеотидів |
| o | в) 5-фосфорильовані нуклеотиди |
| o | г) продукти гідролізу білків |
10. Що визначає послідовність нуклеотидів у полінуклеотидному ланцюгу?
| o | а) визначає первинну структуру НК |
| o | б) не має значення для утворення первинної структури НК |
| o | в) визначає структуру мононуклеотидів |
| o | г) визначає комплементарні міжнуклеотидні зв'язки /двох ланцюгів ДНК |
11. Які нуклеотиди належать ДНК?
| o | а) рибо-АМФ, дезоксирибо-ГМФ, ТМФ, УМФ |
| o | б) дезоксирибозо- АМФ, ГМФ, ЦМФ, ТМФ |
| o | в) дезоксирибозо-АМФ, ГМФ, ЦМФ, УМФ |
| o | г) АМФ, ГМФ, ЦМФ, ТМФ. |
12. Які нуклеотиди належать РНК?
| o | а) УМФ, дезоксирибо-АМФ, рибо-ГМФ, ТМФ |
| o | б) АМФ, ГМФ, УМФ, ТМФ |
| o | в) УМФ, рибозо-АМФ, ГМФ, ЦМФ |
| o | г) ТМФ, УМФ, рибо-АМФ, ГМФ |
13. Чи є в клітинах вільні нуклеотиди?
| o | а) так, є - АМФ, АДФ, АТФ тощо |
| o | б) вільні мононуклеотиди в клітинах с лише продуктами обміну НК |
| o | в) вільні нуклеотиди в клітинах не трапляються |
| o | г) одні вільні мононуклєотиди в клітинах с фізіологічне активними (АМФ, АДФ, АТФ І їм подібні). Інші - продуктами обміну НК |
14. В яких субклітинних структурах, крім ядер, локалізована ДНК?
| o | а) у хлоропластах і мітохондріях - (менше 1 % усієї ДНК клітини) |
| o | б) в апараті Гольджі |
| o | в) у рибосомах |
| o | г) у мембранах (близько 50 % усієї ДНК клітини) |
15. Яку функцію виконують ДНК хромосом?
| o | а) регуляцію метаболізму |
| o | б) обмін енергії |
| o | в) структурно-пластичну (в ядрах клітин) |
| o | г) збереження, передачі і реалізації спадковості |
16. Яку функцію виконують плазматичні мтДНК?
| o | а) регуляцію метаболізму |
| o | б) регуляцію обміну енергії |
| o | в) несуть і реалізують спадковість |
| o | г) не є спадковим (генетичним) матеріалом |
17. Яка будова вторинної структури ДНК у вищих тварин?
| o | а) одноланцюгова спіраль |
| o | б) дволанцюгова спіраль, що складається їж двох антипаралельних ланцюгів |
| o | в) дволанцюгова структура, що складається з РНК- і ДНК-ланцюгів |
| o | г) дволанцюгова спіраль ДНК, на яких синтезовані нитки іРНК |
18. Якими зв'язками утримується структура дволанцюгової спіралі?
| o | а) водневими зв'язками між азотистими основами |
| o | б) водневими зв'язками вуглеводів у двох нуклеотидах |
| o | в) фосфорноефірними зв'язками між вуглеводом одного ланцюга і фосфорною кислотою іншого |
| o | г) ковалентними зв'язками Н2 -груп одного ланцюга та ОС груп іншого |
19. Чим різниться будова вторинної структури РНК і ДНК?
| o | а) різниці в будові вторинної структури РНК і ДНК немає. |
| o | б) рідняться лише розміри ланцюгів |
| o | в) молекули РНК на відміну від ДНК складаються переважно з одного полінуклеотидного ланцюга |
| o | г) вторинна структура РНК характеризується наявністю одного, двох і більше полінуклеотидних ланцюгів |
20. Яку функцію виконують матричні мРНК (ІРНК)?
| o | а) переносять активні амінокислоти під час біосинтезу білків с найбільшими РНК |
| o | б) транскрибують спадкову інформацію синтезу білків (із ДНК на ІРНК), разом з рибосомами та їх рРНК с матрицею біосинтезу білка |
| o | в) є матрицею біосинтезу білка |
| o | г) разом з рибосомами та їх рРНК є матрицею біосинтезу білка. |
21. Яку функцію виконують тРНК?
| o | а) є переносниками активних АК на матрицю |
| o | б) є матрицею біосинтезу білків |
| o | в) не беруть участі в матричному біосинтезі білків |
| o | г) активують АК, перетворюючи їх на аденілати. |
22. Яким чином тРНК беруть участь у процесі трансляції та відіграють роль адаптера(перекладача)?
| o | а) не беруть участі в трансляції нуклеотидних послідовностей, закладених у ДНК, у АК послідовність білка, що синтезується |
| o | б) тРНК включають антикодон, який відповідає конкретному кодону ІРНК, що визначає їх роль адаптера нуклеотидної послідовності в АК |
| o | в) антикодони тРНК не відповідають Д кодону ІРНК, що визначає їх роль адаптера, незалежного від матриці |
| o | г) тРНК активують вільні АК, за рахунок чого вони можуть переноситися на матрицю біосинтезу. |
23. Які особливості має вторинна структура тРНК?
| o | а) закручування одноланцюгових полінуклеотидів |
| o | б) утворення фігур "клеверного листка" |
| o | в) утворення глобул |
| o | г) утворення фібрил |
24. Які закономірності співвідношень азотистих основ у ДНК встановив Е. Чаргаф?
| o | а) Пур=Пір (або Пур/Пір=1); А=Т (або А/Т=1); Г=Ц (або Г/Ц=1) |
| o | б) А+Ц=Г+Т (або (А+Ц)/(Г+Т)=1) |
| o | в) у ДНК із різних об’ектів (А+Т) (Г+Ц)=АТ -тип ДНК, або (Г+Ц) (А+Т) - ГЦ - тип ДНК |
| o | г) усі зазначені співвідношення, що і зумовлює видову специфічність ДНК за нуклеотидним складом. |
25. В яких динуклеотидах фосфат об'єднує два різних мононуклеотиди?
| o | а) у НАД(НАДФ), ФАД(ФАДФ) |
| o | б) у циклічному 2', 3' - АМФ |
| o | в) у циклічному3', 5'-АМФ |
| o | г) у ф-5'-Г-У-3'-ОН |
РОЗДІЛ 4. ФЕРМЕНТИ
4.1. ЗАГАЛЬНЕ ПОНЯТТЯ ПРО ФЕРМЕНТИ
Наука про харчування ґрунтується на точному знанні поетапного розщеплення поживних речовин під впливом ферментів травної системи, на кількісний і якісний склад яких впливає характер нутрієнтів, що надходять. Багато спадкоємних захворювань людини зв'язані з порушенням або відсутністю синтезу специфічних ферментів; уведення їх у комплекс лікувальних засобів компенсує їх нестачу.
В основі всіх процесів життєдіяльності організму лежать тисячі хімічних реакцій, що каталізуються особливими білками - ферментами (ензимами). Назва "фермент" відбулася від латинського слова "fermentum" (закваска); другий термін "ензим" - від грецького en - усередині, zyme - дріжджі. Саме з процесів бродіння починається наука про ферменти.
Завдяки ферментам у живих організмах відбуваються такі дивні перетворення, які в інших умовах не завжди можливі навіть при використанні найсучасніших досягнень науки і техніки. Так, наприклад, для розщеплення молекул пероксиду водню на молекулярний оксиген і воду в присутності заліза потрібно 300 років, у той час як фермент каталаза здійснює цей процес у живій клітці за 1 секунду.
Ферменти обумовлюють прискорення процесів життєдіяльності. Однак при цьому не порушуються загальні закони природи, тому що прискорюються лише ті процеси, що термодинамічно можливі, але протікають повільно. Спрямованість хімічних процесів забезпечується за рахунок упорядкованого розподілу ферментів у клітці, причому одні з них "прив'язані" до визначених структур, інші утримуються в цитоплазмі і мігрують до різних ділянок клітки, підкоряючись регуляторним впливам. Тому в клітках одночасно відбувається безліч різноманітних реакцій у різних, у тому числі і протилежних, напрямках. Цей факт послужив приводом для видатного угорського вченого А. Сент-Дьерді сказав: "Біологія - це наука про неймовірне".
За своєю дією біологічні каталізатори - ферменти - відрізняються від каталізаторів неживої природи. Будучи білками, вони мають складну структуру, тоді як багато неорганічних каталізаторів - низькомолекулярні речовини.
Ферменти характеризуються дуже високою активністю. Ферментативна реакція протікає в 106-1012 разів швидше, ніж спонтанна реакція у водному розчині, яка не каталізується. У живих організмах у присутності ферментів за частки секунд можуть здійснюватися складні упорядковані в часі і просторі реакції, для проведення яких у лабораторних умовах потрібні були б дні, тижні і навіть місяці. Так, 1 г пепсину, ферменту шлункового соку, який каталізує переварювання білків, за 1 годину може гідролізувати 100 кг яєчного білка.
Реакції, що каталізуються ферментами, на відміну від багатьох хімічних реакцій органічних речовин, здійснюваних у лабораторних умовах, йдуть без утворення побічних продуктів, майже з 100-процентним виходом.
Усі ферменти виявляють свою активність у відносно м'яких умовах: при помірній температурі (25-40°С), нормальному тиску, при невисокій концентрації водневих іонів, тобто в умовах, коли хімічні речовини, що входять до складу організму, перетворюються без каталізатора дуже повільно. Як указував шведський хімік Й. Я. Берцеліус, для гідролізу крохмалю до глюкози поза організмом необхідно нагрівати цей полісахарид у розчині кислоти протягом декількох годин, а при участі відповідного ферменту цей процес відбувається при кімнатній температурі і триває усього кілька хвилин.
Наступною істотною відмінністю ферментів від каталізаторів неживої природи є їхня специфічність стосовно типу реакції і до речовин, процес зміни в яких прискорюється даним ензимом.
Ферменти в клітині точно локалізовані. Строга відповідність біохімічних процесів органоїдам клітки обумовлює локалізацію в них тих або інших індивідуальних ферментів, мультиферментних комплексів - поліферментних блоків. Наприклад, у мітохондріях зосереджені комплекси окиснювально-відновних ферментів, у рибосомах - ферменти, що беруть участь у біосинтезі білка, у лізосомах - гідролази, у протоплазмі - ферменти, що активують амінокислоти, у ядерному апараті клітини - в основному ферменти, що здійснюють біосинтез нуклеїнових кислот. Завдяки такій локалізації ферментних систем процес каталізу являє собою серію послідовних елементарних перетворень речовин, найсуворішим образом скоординованих і організованих у просторі і часі. Внаслідок цього окремі цикли охоплюють широке коло реакцій перетворень речовин в організмі (окиснювання і відновлення, ізомеризації, гідролізу й ін.), забезпечуючи тим самим життєдіяльність клітин, тканин, органів і організму в цілому.
У живій клітині може локалізовані ферменти різноспрямованої дії: одні розщеплюють складні органічні речовини на більш прості з виділенням хімічної енергії, інші - при витраті енергії - до біосинтезу біополімерів. Ферменти, які каталізують ці реакції, організовані у ферментні системи (мультиферментні системи), що викликають реакції, які послідовно йдуть одна за одною (від 2 до 20 і більш).
Обмінні реакції, що протікають у клітині під дією ферментів, строго регламентовані: синтезується лише та кількість різних видів простих молекул, яка необхідна для біосинтезу білків, нуклеїнових кислот, ліпідів, полісахаридів і т.п. Така саморегуляція забезпечує певний стаціонарний стан живих структур навіть у випадках значних змін зовнішнього середовища.
Завдяки ферментним системам клітина здатна сама себе підтримувати в постійній динамічній рівновазі і налаштовуватися на роботу в режимі максимальної економії компонентів. Процеси, що протікають у живих організмах, набагато перевершують можливості сучасних хімічних технологій.
В даний час ферментологія, що стала однією з основних галузей біохімії, досягла вагомих результатів. Було відкрито близько 2000 ферментів, з яких 200 отримані в кристалічному виді.
4.2. БУДОВА ФЕРМЕНТІВ
За хімічною будовою ферменти являють собою прості (ферменти-протеїни) і складні білки (ферменти-протеїди).
Ферменти-протеїни складаються лише із білків, тому їх називають однокомпонентними. Складні ферменти, крім білкової, містять і небілкову частину, тому вони одержали назву двокомпонентних.
Білкову частину складного ферменту називають апоферментом (носій), небілкову - додатковою, простетичною групою, коензимом або коферментом (активна частина). Загальна назва складного ферменту - холофермент (від греч. holos - ціле).
Апофермент - термолабільний, як усі білки, кофермент - термостабільний.
Для складних ферментів характерно те, що ні апофермент, ні кофермент окремо не мають вираженої каталітичної активності. Тільки комплекс білкової і небілкової частин виявляє ферментативні властивості. При цьому білковий компонент відповідальний за специфічність ферменту і значно підвищує каталітичні властивості небілкової групи. У той же час небілкова частина обумовлює активність дії і стабілізує білкову частину, робить її більш стійкою до впливів денатуруючих речовин.
Кофермент може легко відокремлюватися від апоферменту і "обслуговувати" два або кілька ферментів, а також існувати самостійно. Той самий кофермент, приєднуючись до різних білків, може каталізувати зовсім різні реакції. Так, в одній реакції піридоксальфосфат (вітамін В6) прискорює трансамінування, а в іншій - декарбоксилювання амінокислот. Кофермент з'єднаний з апоферментом зв'язками різної міцності. Простетична група невіддільна від білкової частини ферменту.
Роль коферментів у складних ферментах виконує більшість вітамінів (В1, В2, В3, В4, В5, В6, В12, Вс, Н и ін.) або сполуки, до складу яких входять вітаміни, іони металів і ін. Наприклад, вітамін Н входить до складу кокарбоксилаз, що каталізують біосинтез вищих жирних кислот, тому що він сприяє асиміляції оксиду карбогену.
До складу коферменту А або коензиму А (КоА і HSKoА), входить пантотенова кислота (вітамін В3).
Реактивною частиною КоА є HS-група меркаптоетиламіну:

Поряд з вітамінами коферментну функцію можуть виконувати деякі пептиди, наприклад HS-глутатіон (g-глутамінилцистеїніл-гліцин), що бере участь в окиснювально-відновних процесах, а також велика група нуклеотидів.
В якості коферментів можуть виступати ефіри деяких моносахаридів, ліпоєва кислота і ряд інших речовин.
У тих випадках, коли до складу кофактора входять іони металів, вони виконують функцію містка, що зв'язує фермент із субстратом, у результаті чого утворюється координаційний комплекс. Іони металів можуть знаходитися також у структурі активного центра, де вони беруть безпосередню участь у каталізі (наприклад, у каталазі, пероксидазі, цитохромоксидазі). У табл. 4.1. приведена класифікація за хімічною будовою найбільш розповсюджених коферментів.
Таблиця 4.1.
Класифікація коферментів
| Назва коферменту | Вихідна речовина для утворення коферменту |
| Вітамінні коферменти | |
| Тіамінові (ТДФ) Флавінові (ФМФ, ФАД) Пантотенові (КоА) Нікотинамідні (НАД, НАДФ) Піридоксинові (піридоксальфосфат) Фолієві (ТГФК) Кобаламідні Біотинові | тіамін (вітамін В1) рибофлавін (вітамін В2) пантотенова кислота (вітамін В3) нікотинамід (вітамін РР) піридоксин (вітамін В6) фолієва кислота (вітамін Вс) вітамін В12 біотин (вітамін Н) |
| Невітамінні коферменти | |
| Містять метали Металопорфіринові Пептидні Вуглеводні Нуклеотидні (УДФГ) (не є похідними вітамінів) | Мn, Mg, Fe, Zn, Mo, Ca геми, хлорофіл глутатіон фосфати моносахаридів нуклеозидмоно- і дифосфати |
Відомі складні ферментні системи, що містять декілька ферментних білків і коферментів.
Взаємодія ферменту з речовиною (субстратом), що піддається зміні, забезпечується наявністю на поверхні ферменту відповідної ділянки, структура якої комплементарна структурі субстрату, тобто підходить до нього, як ключ до замка.
У простих ферментах-протеїнах каталітичну функцію виконує частина білкової молекули, названа активним (каталітичним) центром, що являє собою унікальне сполучення певних амінокислотних залишків, що входять до складу пептидного ланцюга ферменту. Архітектоніка центра забезпечує взаємодію з визначеними групами субстрату. Найбільш часто в складі активних центрів зустрічаються залишки серину, тирозину, гістидину, триптофану, аргініну, цистеїну, аспарагінової і глутамінової кислот. Амінокислотні залишки, що обумовлюють каталітичну активність простого ферменту, розташовуються в різних ділянках поліпептидного ланцюга.
В ряді двокомпонентних ферментів виявляються два активних центри: субстратзв’язуючий і алостеричний.
Субстратзв’язуючий центр являє собою ділянку молекули ферменту, що безпосередньо взаємодіє із субстратом. У ферментах-протеїнах субстратзв’язуючий центр може збігатися з активним центром.
Алостеричний центр - це ділянка молекули ферменту, за будовою не ідентична субстратові (від греч. allos – інший). Він взаємодіє з визначеними низькомолекулярними речовинами, наприклад гормонами. Приєднання таких речовин до алостеричного центру приводить до зміни третинної структури білкової молекули. Це у свою чергу змінює конфігурацію субстратзв’язуючого центру і супроводжується зміною (збільшенням або зменшенням) каталітичної активності ферменту.
4.3. ВЛАСТИВОСТІ ФЕРМЕНТІВ
Усі ферменти є високомолекулярними біополімерами. Білкова природа ферментів визначає ряд особливостей, що відрізняють їх від неорганічних каталізаторів.
Найважливіша особливість дії ферментів полягає в специфічності, що обумовлює вибірковість їхньої дії. Досить змінити просторове розташування атомів субстрату, щоб фермент не впливав на нього. Фермент може каталізувати одну або групу реакцій, близьких за своєю природою.
Завдяки своїй специфічності ферменти вибирають з ряду термодинамічно можливих хімічних реакцій лише деякі і тому не тільки прискорюють біохімічні перетворення, але і часто визначають загальний напрямок метаболічних процесів.
У залежності від того, чи може фермент каталізувати яку-небудь одну реакцію (тобто діяти на даний субстрат) або кілька реакцій (тобто діяти на визначену групу субстратів), розрізняють специфічність абсолютну і відносну.
Абсолютна специфічність характерна для ферментів, що діють на один субстрат з цілком визначеною структурою. Будь-які зміни в структурі субстрату роблять його недоступним для дії ферменту.
До таких ферментів відносять уреазу, яка каталізує розпад сечовини і не діє ні на які інші сполуки, навіть на похідні сечовини, наприклад метилсечовину. До цієї групи ферментів відноситься також аргіназа, що розщеплює аргінін в природних умовах.
Відносну специфічність мають ферменти, що діють на визначений вид зв'язку. Наприклад, пептидази гідролізують усі сполуки, що мають у своєму складі пептидний зв'язок -СО-NH.
Ферменти, що мають відносну специфічність, мають широкий спектр дії. Відносна групова специфічність характерна для ферментів, що діють на субстрати, що мають однаковий тип зв'язку і певне функціональне угрупування. Вони не тільки впливають на той або інший тип хімічного зв'язку, але і допускають зміни хімічної структури субстрату. Наприклад, ліпази і естерази розщеплюють як різні триацилгліцероли (жири), так і диацилгліцероли, моноацилгліцероли і складні ефіри. Однак розщеплення цих субстратів відбувається з різною швидкістю.
Деякі ферменти діють на субстрати, що мають тільки визначену просторову конфігурацію, тобто виявляють просторову, оптичну, стереоізомерну специфічність. Наприклад, ферменти дріжджової клітки каталізують зброджування - розпад D-глюкози з утворенням етилового спирту і оксиду карбогену, але не впливають на L-глюкозу. Стереоізомірна специфічність визначається не тільки D і L, але й іншими типами ізомерії. Фермент, що діє на субстрат з цис-конфігурацією, як правило, не атакує трансізомер даної сполуки, і навпаки.
З інших властивостей ферментів варто вказати на оборотність їхньої дії.
У залежності від концентрації вхідних і кінцевих продуктів реакції ферменти можуть каталізувати як прямі, так і зворотні реакції, тобто викликати як процеси синтезу, так і процеси розпаду. Вперше на цю особливість звернув увагу видатний російський хімік А. Я. Данилевський (1886 р.). Він показав, що фермент шлункового соку пепсин, що розщеплює білки на пептони і альбумози (уламки білкової молекули), у певних умовах може каталізувати синтез білків з цих проміжних продуктів обміну білків. Однак пізніше було доведено, що зворотність дії характерна не для усіх ферментів.
Багато процесів розпаду і синтезу відбуваються не тільки під дією різних ферментів, але і за іншим механізмом. У живому організмі розщеплення і синтез здійснюються в більшості випадків різними ферментами навіть тоді, коли даний фермент здатний каталізувати реакцію в різних напрямках. У синтезі беруть участь ферменти, що використовують енергію гідролізату АТФ і деяких інших сполук. Так, при гідролізі глікогену в печінці за допомогою амілази і мальтази утворюється глюкоза. З глюкози там же, у печінці, синтезується глікоген, але його утворення не є наслідком зворотної реакції гідролізу, а відбувається більш складним шляхом.
Для ферментів характерна чутливість до зміни температури (термолабільність), особливо до її підвищення. Висока температура, яка денатурує білки, інактивує ферменти (рис. 4.1.).

Рис 4.1. Термолабільність ферментів
Встановлено, що ферменти тваринного походження виявляють найбільшу активність при температурі 37-400С, а рослинного - при 50 і 60°С. Таку температуру називають температурним оптимумом (мал. 4.1.). Однак є виключення, наприклад, каталаза найбільш активна при температурі 0-100С.
Нагрівання до температури 50-600С послабляє дію ферментів тваринного походження. При температурі 70°С і вище більшість з них цілком втрачає свою активність. При зниженій температурі (гіпотермія) активність ферментів знижується, але не зникає. Встановлено, що в холодильних камерах у замороженому м'ясі відбувається повільне розщеплення білків під дією протеолітичних ферментів. Коли для ферментів створюється температурний оптимум, вони знову стають активними. Прикладом може служити зимове спання тварин. Цю здатність ферментів використовують у хірургії, кріобіології.
На активність ферментів впливає певна концентрація водневих іонів - рН середовища. Для кожного ферменту існує визначена вузька межа рН середовища, що є оптимальним для реалізації його максимальної активності. Відхилення рН від оптимального значення приводить до зниження активності ферменту або навіть до його необоротної інактивації. Оптимальне значення рН середовища складає для пепсину 1,5-2,5, трипсину - 8,0-8,5, амілази слини - 6,8-7,4, аргінази - 9,7.
Зміни в каталітичній дії ферментів при різних значеннях рН середовища можуть бути зв'язані зі змінами конфігурації унікальної структури молекули - її активного центра.
Швидкість ферментативних реакцій залежить не тільки від температури і рН середовища, але і від концентрації ферменту і субстрату, наявності активаторів і паралізаторів.
Швидкість дії ферменту визначається концентрацією фермент-субстратного комплексу, що утвориться. Максимальна швидкість реакції досягається тоді, коли концентрація субстрату буде достатня, щоб зв'язати всю кількість ферменту у фермент-субстратний комплекс.
Крім зазначених факторів, на активність ферментів впливає присутність у розчині ряду хімічних сполук, що можуть активувати (активатори) або гальмувати (інгібітори) дію ферментів. Активатори представлені іонами багатьох металів (найбільше часто Mg2+, Мn2+, К+, Со2+), деякими аніонами (Сl-). Так, амілаза слини і підшлункової залози активуються аніонами хлору; дія ліпази соку підшлункової залози стимулюють жовчні кислоти.
Не нашли, что искали? Воспользуйтесь поиском: