
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Загальна характеристика 18 страница
Пептиди, що утворилися в результаті дії на білки пепсину, трипсину і хімотрипсину в нижніх відділах тонкої кишки, піддаються подальшому розщепленню. Цей процес здійснюють карбоксипептидази, амінопептидази. Ці ферменти відносяться до металоферментів. Вони активуються двовалентними іонами Mg2+, Mn2+, Со2+, що відіграють важливу роль у формуванні фермент-субстратного комплексу.
Механізм дії аміно- і карбоксипептидаз полягає у відщіпленні від пептидів кінцевих амінокислот, що мають вільну амінну або карбоксильну групу. Невеликі пептиди, що залишилися нерозщепленими і складаються з трьох-чотирьох амінокислотних залишків, піддаються гідролізу специфічними ди- і триамінопептидазами.
Еластаза – ендопептидаза, що також має широку субстратну специфічність, розщеплюючи пептидні звязки, що утворюються залишками амінокислот малого розміру – гліцину, аланіну, серину.
Таким чином, у результаті послідовної дії на білки протеолітичних ферментів у кишечнику утворюються вільні амінокислоти, що всмоктуються в кров через стінку кишечнику.
10.3. УТВОРЕННЯ В КИШЕЧНИКУ ОТРУТНИХ ПРОДУКТІВ РОЗПАДУ БІЛКІВ Й ЇХНЄ ЗНЕШКОДЖЕННЯ
Амінокислоти, що не всмокталися в кров через слизову оболонку тонкої кишки, піддаються впливу мікроорганізмів у товстому кишечнику. При цьому ферменти мікроорганізмів розщеплюють амінокислоти і перетворюють їх в аміни, жирні кислоти, спирти, феноли й інші речовини, нерідко отрутні для організму. Цей процес іноді називають гниттям білків у кишечнику. У його основі лежить декарбоксилювання амінокислот, при цьому з амінокислот з'являються біологічні аміни. Так, з амінокислоти орнітину утворюється путресцин:

З лізину утворюється кадаверин:

Путресцин і кадаверин виводяться з організму з фекальними масами. У тих випадках, коли ці сполуки попадають у кров, вони виводяться із сечею в незміненому виді.
З тирозину утворюється крезол, а якщо процес йде далі, то і фенол:

З триптофану утворюються скатол і індол:

При глибокому руйнуванні кишковими мікроорганізмами сірковмісних амінокислот - цистіну, цистеїну і метіоніну - утворюється сірководень (H2S), меркаптан (CH3SH) і інші сірковмісні сполуки.
Продукти гниття білків всмоктуються у венозну кров, потім попадають у печінку, де і знешкоджуються за допомогою сірчаної або глюкуронової кислоти.
Цей процес здійснюється за наступною схемою:

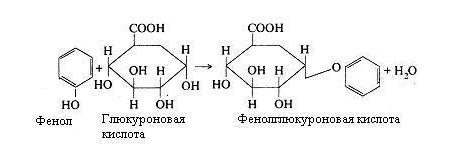
Індол і скатол також знешкоджуються в печінці при участі сірчаної і глюкуронової кислот. Однак вони попередньо окислюються: скатол у скатоксил, індол у індоксил і у виді парних кислот виводяться з організму із сечею.

Деякі отруйні речовини, наприклад бензойна кислота, що утворилася з фенілаланина, знешкоджуються в печінці за допомогою гліцину. При цьому утворюється гіпурова кислота - нешкідлива сполука, що виділяється із сечею.

Можливості печінки в знешкодженні утворених в товстій кишці отрутних речовин, що всмокталися в кров, не безмежні. При зниженні її функціональної здатності (наприклад, у зв'язку з перенесеними раніше захворюваннями) надходження значної кількості отруйних речовин може виявитися надмірним навантаженням, тоді частина незнешкоджених отруйних речовин розноситься (великим колом кровообігу) по всьому організму, викликаючи його отруєння. Відбувається передчасне старіння клітин і їхня загибель. При цьому відзначається погіршення самопочуття людини, її мучать головні болі.
Для попередження негативного впливу отруйних речовин на організм необхідно раціонально планувати харчовий раціон. У нього повинні бути включені продукти, що містять не тільки білки, але і жири і вуглеводи, корисні кисломолочні продукти, тому що молочнокислі бактерії сприяють прискоренню загибелі гнильних мікроорганізмів товстої кишки. У раціоні необхідна їжа, що є джерелом пектинових речовин і клітковини, що, підвищуючи рухову активність кишечнику, сприяють виведенню шлаків (у тому числі й отруйних речовин) з організму.
10.4. КАТАБОЛІЗМ БІЛКІВ І АМІНОКИСЛОТ У ТКАНИНАХ
Основна частина амінокислот, що утворюються в кишечнику з білків, надходить у кров (95%) і невелика частина - у лімфу. По ворітний вені амінокислоти попадають у печінку, де витрачаються для біосинтезу різних специфічних білків (альбумінів, глобулінів, фібриногену), інші амінокислоти струмом крові розносяться до всіх органів і тканин, транспортуються усередину кліток, де вони використовуються для біосинтезу білків. Невикористані амінокислоти окиснюються до кінцевих продуктів обміну.
Процес розщеплення тканинних білків каталізується тканинними ферментами - протеїназами- катепсинами.
Співвідношення між амінокислотами в білках, що розпадаються і синтезуються, різне, тому частина вільних амінокислот повинна бути перетворена в інші амінокислоти або окиснена до простих сполук і виведена з організму. Отже, в організмі існує внутрішньоклітинний запас амінокислот, що значною мірою поповнюється за рахунок процесів взаємоперетворення амінокислот, гідролізу білків, синтезу амінокислот і надходження їх з позаклітинної рідини. У той же час завдяки синтезові білків і інших реакцій (утворенню сечовини, пуринів і т.п.) постійно відбувається видалення вільних амінокислот з позаклітинної рідини.
Шляхи обміну амінокислот
В основі різних шляхів обміну амінокислот лежить три типи реакцій: за амінною і карбоксильною групами і за бічним ланцюгом. Реакції за амінною групою включають процеси дезамінування, переамінування, амінування, за карбоксильною групою - декарбоксилювання. Безазотиста частина вуглецевого кістяка амінокислот піддається різним перетворенням з утворенням сполук, що потім можуть включатися в цикл Кребса для подальшого окиснювання.
Шляхи внутрішньоклітинного перетворення амінокислот складні і перехрещуються з багатьма іншими реакціями обміну, у результаті чого проміжні продукти обміну амінокислот можуть служити необхідним попередником для синтезу різних компонентів клітин і бути біологічно активними речовинами.
Катаболізм амінокислот у ссавців відбувається в основному в печінці і трохи слабкіше в нирках.
Дезамінування амінокислот
Суть дезамінування полягає в розщепленні амінокислот під дією ферментів на аміак і безазотистий залишок (жирні кислоти, оксикислоти, кетокислоти). Дезамінування може йти у виді відбудовного, гідролітичного, окисного і внутрімолекулярного процесів. Останні два типи переважають у людини і тварин.
Схематично дезамінування можна представити в такий спосіб:
а) відбудовне

б) гідролітичне

в) внутрімолекулярне
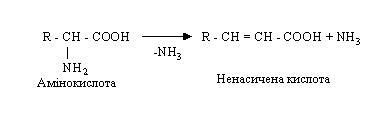
г) окисне

Окисне дезамінування підрозділяється на дві стадії.

Перша стадія є ферментативною, вона закінчується утворенням нестійкого проміжного продукту - імінокислоти, що у другій стадії спонтанно в присутності води розпадається на аміак і a-кетокислоту. Ферменти, які каталізують цей процес, містять у якості простетичної групи НАД або ФАД.
В організмі людини найбільше активно протікає дезамінування глутамінової кислоти під дією ферменту глутаматдегідрогенази, що знаходиться в мітохондріях клітин усіх тканин. У результаті цього процесу утворює a-кетоглутарова кислота, що бере участь у багатьох процесах обміну речовин.
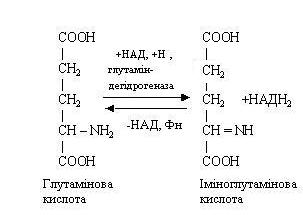

Трансамінування (переамінування) амінокислот
Реакція перетворення амінокислот без утворення аміаку була відкрита в 1938 р. радянськими академіками А. Е. Браунштейном і И. Г. Крицманом, що розробили загальну теорію механізму цього ферментативного процесу.
Обов'язковою умовою трансамінування є участь дикарбонових амінокислот (глутамінової і аспарагінової), що у виді відповідних їм кетокислот - a-кетоглутарової і щавелевооцтової можуть взаємодіяти з всіма амінокислотами, за винятком лізину, треоніну й аргініну.
При переамінуванні відбувається безпосередній перенос аміногрупи з амінокислоти на кетокислоту, а кетогрупи - з кетокислоти на амінокислоту без звільнення при цьому аміаку.
Цей процес протікає в кілька етапів. У загальному виді реакція виглядає так:

Реакцію каталізують ферменти, що відносяться до класу трансфераз, їх простетичною групою є фосфорпіридоксаль - фосфорний ефір вітаміну В6.
Процес переамінування широко розповсюджений у живій природі. Його особливість - легка оборотність.
Реакції переамінування відіграють велику роль в обміні речовин. Від них залежать такі найважливіші процеси, як біосинтез багатьох замінних амінокислот з відповідних їм кетокислот, розпад амінокислот, об'єднання шляхів вуглеводного й амінокислотного обміну, коли з продуктів розпаду глюкози, наприклад піровиноградної кислоти, може утворитися амінокислота аланін, і навпаки.
Відбудовне амінування. Цей процес протилежний дезамінуванню. Він забезпечує зв'язування аміаку кетокислотами з утворенням відповідних амінокислот.
Відбудовне амінування каталізується добре функціонуючою ферментною системою, що забезпечує амінування a-кетоглутарової або щавелевооцтової кислоти з утворенням глутамінової або аспарагінової кислоти.

При знешкодженні аміаку неорганічними й органічними кислотами відбувається утворення амонійних солей. Цей процес здійснюється в нирках. Амонійні солі, що утворилися, виводяться з організму із сечею і потім.
Декарбоксилювання амінокислот
Процес декарбоксилювання каталізується декарбоксилазами, специфічними для кожної амінокислоти, простетичною групою яких служить піридоксальфосфат. Ці ферменти відносяться до класу ліаз. Процес декарбоксилювання, що полягає у відщіпленні від амінокислот СО2 з утворенням амінів, можна показати на наступній схемі:

Механізм реакції декарбоксилювання амінокислот відповідно до загальної теорії піридоксалевого каталізу зводиться до утворення піридоксальфосфат-субстратного комплексу в активному центрі ферменту.
Таким шляхом із триптофану утворюється триптамін, з гідрокситриптофана - серотонін.


З амінокислоти гістидин у утворюється гістамін.

З глутамінової кислоти при декарбоксилюванні утворюється g-аміномасляна кислота (ГАМК).

Аміни, утворені з амінокислот, називають біогенними амінами, тому що вони виявляють на організм могутній біологічний ефект.
Біогенні аміни виявляють фізіологічну дію в дуже малих концентраціях. Так, введення в організм гістамину приводить до розширення капілярів і підвищення їхньої проникності, звуження великих судин, скорочення гладких м'язів різних органів і тканин, підвищення секреції соляної кислоти в шлунку. Крім того, гістамін бере участь у передачі нервового порушення.
Серотонін сприяє підвищенню кров'яного тиску і звуженню бронхів; його малі дози придушують активність центральної нервової системи, у великих дозах ця речовина робить стимулюючу дію. У різних тканинах організму великі кількості гістаміну і серотоніну знаходяться в зв'язаній, неактивній формі. Біологічну дію вони виявляють тільки у вільній формі.
Гама-аміномасляна кислота (ГАМК) накопичується в мозковій тканині і являє собою нейрогуморальний інгібітор-медіатор гальмування центральної нервової системи.
Великі концентрації цих сполук можуть являти загрозу для нормального функціонування організму. Однак у тваринних тканинах мається аміноксидаза, що розщеплює аміни до відповідних альдегідів, що потім перетворюються в жирні кислоти і розпадаються до кінцевих продуктів.
10.5. ПРОЦЕСИ ЗНЕШКОДЖЕННЯ АМІАКУ
У процесі перетворення амінокислот у тканинах утворюються їхні кінцеві продукти обміну - оксид карбогену, вода й аміак. Вода використовується організмом для забезпечення біохімічних процесів. Оксид карбогену частково виводиться з організму з видихуваним повітрям, інша його частина утилізується в процесах синтезу (наприклад, при синтезі жирних кислот, пуринових основ і т.д.). Аміак, що утворюється в результаті дезамінування амінокислот, є токсичною речовиною, збільшення його концентрації в крові й інших тканинах робить несприятливу дію, особливо на нервову систему. Токсичність аміаку обумовлена тим, що він сприяє відбудовному амінуванню a-кетоглутарової кислоти в мітохондріях. Це приводить до видалення її з циклу Кребса і, як наслідок, до падіння тканинного дихання і надлишкового утворення кетонових тіл з ацетил-КоА.
У процесі еволюції живі організми виробили різні ефективні механізми зі знешкодження токсичної дії аміаку, основними з яких є: утворення амінів глутаміну або аспарагіну, відбудовне амінування, нейтралізація кислот, синтез сечовини.
Синтез глютаміну або аспарагіну має велике значення для організму. Він протікає в місцях безпосереднього утворення аміаку (наприклад, у печінці, мозку), там же знаходиться і фермент, каталізуючий цей процес, глутамінсинтетаза, що відноситься до класу лігаз. Синтез амідів вимагає доставки енергії у виді АТФ, присутності глутамінової або аспарагінової кислот, вільного аміаку і відповідних специфічних ферментів. Реакція синтезу аміду пов’язана з розпадом АТФ.
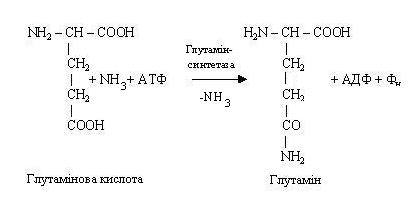
Аналогічно утворюється і аспарагін.
У результаті взаємодії аміаку з глутаміновою і аспарагіновою кислотами відбувається його зв'язування, і в такий спосіб аміак знешкоджується. Зв'язаний аміак може бути використаний як джерело азоту (наприклад, для синтезу пуринових і піримідинових основ, мукополисахаридів). Глутамін і аспарагін не тільки знешкоджують аміак, але і виступають у якості його транспортної форми. У зв'язаному виді аміак доставляється до місця остаточної утилізації - у печінку, де з нього синтезується сечовина.
Синтез сечовини. Одним з найбільш ефективних методів знешкодження аміаку є синтез сечовини. Вперше схема синтезу сечовини була запропонована російським біохіміком М. В. Ненцким, який вважав, що сечовина утворюється з двох молекул аміаку й однієї молекули вугільної кислоти. При цьому у вугільній кислоті гідроксильні групи заміщаються аміаком з утворенням проміжної сполуки карбоновокислого амонію.

Однак надалі експериментального підтвердження ця теорія не знайшла. Карбоновокислий амоній у печінці практично не виявляється. Крім того, ця речовина не менш отрутна, ніж аміак.
У спеціальних дослідах М. В. Залесского і С. С. Салазкіна на тваринах (лабораторія акад. І. П. Павлова) було встановлено, що якщо венозну кров направити не в печінку, а, минаючи її, у нижню порожню вену, то спостерігаються різке збільшення вмісту аміаку в крові й отруєння. На підставі цих результатів був зроблений висновок, що печінка є органом, у якому відбувається знешкодження аміаку.
У роботах X. А. Кребса й інших дослідників була показана участь у даному процесі речовин і ферментів, каталізуючих реакції синтезу сечовини. Англійський біохімік Х. Кребс вніс великий вклад у сучасну теорію синтезу сечовини. Він встановив, що цей процес носить циклічний характер, і вказав на роль у ньому орнітину. Передумовою для створення теорії синтезу сечовини було виявлення в печінці амінокислоти орнітину і ферменту аргінази, що розщеплює аргінін на орнітин і сечовину. За теорії Кребса, синтез сечовини починається взаємодією орнітину з аміаком і оксидом карбогену. При цьому утворюється цитрулін, що взаємодіє з ще одною молекулою аміаку з виділенням аргініну. Останній гідролізується аргіназою на орнітин і сечовину. Орнітин у цих реакціях виконує роль каталізатора. За відкриття цього циклу X. А. Кребс був визнаний гідним Нобелівської премії.
Замкнутий цикл синтезу сечовини умовно можна розділити на три етапи. На першому і другому етапах відбувається зв'язування двох молекул аміаку в нешкідливу для організму сполуку, на третьому етапі утворюється сечовина.
Перший етап. За рахунок енергії АТФ із молекули аміаку й оксиду карбогену синтезується карбомоїлфосфат. Потім відбувається конденсація карбомоїлфосфату з орнітином, у результаті якої синтезується цитрулін. При цьому вивільняється неорганічний фосфат.
Синтез цитруліну забезпечується за рахунок енергії, акумульованої в карбомоїлфосфаті.
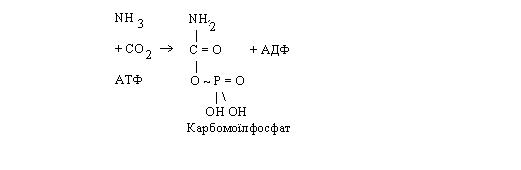
Таким чином, у цитруліні зафіксована одна молекула аміаку.

Другий етап. Відбувається зв'язування ще однієї молекули аміаку в глутамінову кислоту шляхом відбудовного амінування з a-кетоглутаровою кислотою. Глутамінова кислота передає зафіксовану молекулу аміаку у виді NH2-групи на щавелевооцтову кислоту, що перетворюється в аспарагінову кислоту (процес переамінування):

Третій етап. На цьому етапі здійснюється синтез сечовини. Цитрулін, взаємодіючи з аміногрупою аспарагінової кислоти, утворює аргінінобурштинову кислоту (аргінінсукцинат).
У цьому процесі використовується енергія ще однієї молекули АТФ.

Аргінінобурштинова кислота розщеплюється на аргінін і фумарову кислоту. Фумарова кислота включається у вуглеводний обмін, перетворюючись в яблучну, котра шляхом дегідрування переходить у щавелевоцтову.

Щавелевооцтова кислота може приєднувати до себе аміак і знову перетворюватися в аспарагінову кислоту або, піддаючись декарбоксилюванню, у піровиноградну, а потім у коензим А, що використовується в різних реакціях біосинтезу або окисляється до СО2 і Н2О.
Аргінін, що утворився, під дією аргінази гідролітично розщеплюється на орнітин і сечовину.

Орнітин, що вивільнився, може знову вступити в реакцію з новою молекулою карбомоїлфосфату і процес повториться.
Підраховано, що в стані азотистої рівноваги організм дорослої людини споживає і відповідно виділяє 15 г азоту; з екскретованого із сечею азоту на долю сечовини приходиться близько 85 %, креатініну - 5, амонійних солей - 3, сечової кислоти - 1, інших його форм - 6.
10.6. ОБМІН ХРОМОПРОТЕЇНІВ
Еритроцити утворюються з ретикулярних кліток кісткового мозку. Кожен еритроцит має свій життєвий цикл в організмі, що закінчується його руйнуванням. Кількість еритроцитів, що зруйнувалися, відповідає кількості тих, що знову утворилися і, таким чином, маса їх у крові не змінюється. Щодоби руйнується 0,85 % усієї маси еритроцитів крові. Терміни життя еритроцитів не однакові в різних видів тварин. У людини цей термін - 126 днів, у собаки - 107 днів, у кішки й у кролика - 68 днів.
Типи гемоглобіну. Гем при утворенні гемоглобіну зв'язується з глобіном. Глобін - білок, близький за своїми властивостями до альбумінів. Зв'язок між гемом і глобіном здійснюється за допомогою імідазольного ядра гістидину, що входить до складу глобіну.
Гемоглобін є головним протеїном еритроцитів. Він містить 0,338 % заліза. Гемоглобін побудований з чотирьох субодиниць, кожна з яких є поліпептидом. Кожні два поліпептиди за своєю структурою ідентичні. Молекулярна вага субодиниці дорівнює 16 500, отже, молекулярна вага гемоглобіну дорівнює 66 000.
Кожна субодиниця зв'язана з одною молекулою гема і всі чотири гема знаходяться на поверхні загальної молекули. Зв'язування гемів субодиницями глобіну приводить до стабілізації молекули гемоглобіну.
Розпад гемоглобіну. Еритроцити через 120-130 днів після свого виникнення в кістковому мозку і появи в крові фагоцитуються клітинами ретикулоендотеліальної системи (макрофагами). Макрофаги містяться, головним чином, у селезінці, печінці і кістковому мозку. У макрофагах відбувається руйнування еритроцитів і розпад їхньої головної складової частини - гемоглобіну. В гемі розриваються містки, що з'єднують пірольні ядра, у результаті чого утворюється вердогемоглобін, пофарбований у зелений колір. Вердогемоглобін потім розпадається зі звільненням глобіну, заліза і білівердину. З білівердину в результаті відновлення утворюється білірубін.
Залізо, що звільнилося з гема, зв'язується білком плазми (b-глобуліном) і ним транспортується в печінку, де воно відкладається у виді ферітину або ж доставляється в кістковий мозок, де використовується для синтезу гемоглобіну нових еритроцитів.
Білірубін у комплексі з білком доставляється кров'ю в печінку. У печінці цей комплекс розпадається і білірубін надходить у жовчні канальці, а потім через протоки в жовчний міхур. З жовчного міхура білірубін у виді складової частини жовчі надходить у дванадцятипалу кишку.
У кишечнику під впливом кишкової флори білірубін відновлюється з утворенням безбарвного мезобілірубіногену, з якого виникають різні пігменти.
У кишечнику з мезобілірубіногену утворюється деяка кількість стеркобіліногену, він всмоктується кишечником у кров, що доставляє його в печінку. З печінки частина стеркобіліногену разом з жовчю надходить у кишечник, а інша частина його з кров'ю доставляється до нирок і виділяється із сечею.
10.7. ОБМІН НУКЛЕЇНОВИХ КИСЛОТ В ОРГАНІЗМІ
Нуклеїнові кислоти входять до складу клітин у виді складних білків - нуклеопротеїнів, що надходять в організм із продуктами харчування. У шлунку під дією соляної кислоти і пепсину вони розщеплюються на прості білки і нуклеїнові кислоти. Соляна кислота розриває зв'язки між нуклеїновою кислотою і білками (гістаміни і протаміни), а інші, більш стійкі зв'язки при рН шлункового соку (1,5-2,5), розщеплює головним чином пепсин.
У тонкому кишечнику під дією трипсину, хімотрипсину і пептидаз білки розщеплюються до амінокислот, які всмоктуються слизовою оболонкою і надходять у кров. Нуклеїнові кислоти під впливом ферментів підшлункової залози і тонкого кишечнику – нуклеаз - розпадаються до мононуклеотидів. Останні під дією ферментів кишкового соку втрачають фосфорну кислоту і перетворюються в нуклеозиди. Далі нуклеозиди під дією нуклеозидаз розпадаються на складові частини - азотисті основи і пентози. Однак нуклеозидази тонкого кишечнику недостатньо активні і не можуть забезпечити розщеплення всієї маси нуклеотидів. У зв'язку з цим у кров всмоктуються в основному мононуклеотиди і нуклеозиди, що піддаються специфічним перетворенням у тканинах.
Тканинні нуклеїнові кислоти під дією нуклеаз розщеплюються до мононуклеотидів, а потім до азотистих основ, пентоз і фосфорної кислоти.
Фосфорна кислота бере участь у фосфорилюванні, а також у буферних системах, синтезі фосфоліпідів, фосфопротеїнів, АТФ і інших сполук. З організму виводиться переважно у виді кислих солей натрію разом із сечею.
Пентози можуть окислятися до СО2 і Н2О або використовуватися для синтезу глюкози, нуклеотидів.
Утворення сечової кислоти
Пуринові основи в тканинах піддаються дезамінуванню під впливом дезаміназ. У результаті з аденіну і гуаніну через ряд проміжних етапів утворюється сечова кислота, при дезамінуванні аденін перетворюється спочатку в гіпоксантин.
Потім гіпоксантин окисляється в ксантин, який у присутності води за допомогою ферменту ксантиноксидази окисляється до сечової кислоти.

При дезамінуванні гуаніну утворення сечової кислоти відбувається ще швидше, ніж при дезамінуванні аденіну.
При відщіпленні аміногрупи від гуаніну відразу утвориться ксантин, а потім сечова кислота. Сечова кислота є кінцевим продуктом обміну пуринових основ в організмі людини.
При надмірному споживанні м'ясних продуктів і посиленому біосинтезі пуринових основ, у тому числі за рахунок амінокислот (аспарагінової, глутамінової, гліцину), а також при ускладненому виведенні сечової кислоти з організму розвивається захворювання - подагра. У хворих збільшується концентрація сечової кислоти, у 10-15 разів перевищуюча норму. Важко розчинена сечова кислота погано виводиться із сечею і відкладається у виді солей в області дрібних суглобів і під шкірою. Навколо вузликів виникає запальна ділянка, що приводить до порушення функції суглобів, болю.
Піримідинові основи не переходять у пуринові, тому вони не можуть бути джерелом сечової кислоти. На відміну від пуринових дезаміновані піримідинові основи відновлюються, потім розпадаються до оксиду карбогену і аміаку.
NH3 і СО2, що вивільняються в результаті цих реакцій, використовуються для біосинтезу сечовини, азотистих основ, у процесах декарбоксилювання та інших реакціях.
10.8. БІОСИНТЕЗ БІЛКА
Біосинтез білка протікає у всіх клітках живого організму і забезпечує відновлення білкового складу, процеси обміну речовин і їхню регуляцію, а також ріст і диференціювання органів і тканин. Білки синтезуються в тканинах з вільних амінокислот при участі нуклеїнових кислот. Вони знаходяться в процесі постійного розщеплення і синтезу. Швидше усіх відновлюються білки плазми крові, печінки, нирок, слизової оболонки тонкої кишки і підшлункової залози. Протягом дев'яти діб обновляється близько 50 % білків печінки. Повільніше цей процес відбувається в м'язах (кожні 120 днів), шкірі й особливо нервовій системі.
У середньому усі білки обновлюються в організмі приблизно за 135-155 діб. За добу в людини синтезується в середньому 1,3 г білку на 1 кг маси тіла, що при середній масі 70 кг складає близько 90 г. Отже, для забезпечення процесу біосинтезу білків необхідно достатнє надходження харчових речовин.
Процес біосинтезу білка протікає зі споживанням енергії, акумульованої у виді АТФ. При цьому забезпечується утворення визначених білків строго специфічної структури, що закодована в ДНК.
Процес синтезу білка можна розділити на три основних етапи. На першому етапі, що зветься транскрипція (від лат. transcrіptіo - зчитування), відбувається синтез молекул М-РНК на ДНК, після чого М-РНК надходять до рибосом. Таким способом відбувається передача інформації про будову синтезованого білка на рибосоми - місце їхнього безпосереднього утворення. Другий етап - рекогніція (від лат. recognіtіon - впізнавання) - це з'єднання амінокислот, необхідних для синтезу поліпептидних ланцюгів, зі специфічними Т-РНК і доставка їх у такому виді в рибосоми. Третій етап - трансляція (від лат. translatіon - переклад) складається в перекладі нуклеотидної послідовності М-РНК в амінокислотну послідовність поліпептидного ланцюга в процесі синтезу білка на рибосомі.
Репродукція білків у всіх організмів відбувається за принципом матричного синтезу за участю нуклеїнових кислот. Під матричним синтезом мається на увазі процес відтворення білків у точній відповідності з програмою. Носієм і хоронителем генетичної інформації є ДНК. Саме в послідовності нуклеотидів ДНК запрограмована інформація, тобто складена матриця, відповідно до якої синтезується визначений білок.
Не нашли, что искали? Воспользуйтесь поиском: