
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Концентрация растворов
ФАЗОВЫЕ РАВНОВЕСИЯ В ОРГАНИЧЕСКИХ И НЕОРГАНИЧЕСКИХ СИСТЕМАХ
ЧАСТЬ I. РАСТВОРЫ
Учебно-методическое пособие для студентов и магистров по специальности
020100 – Химия ДО
Воронеж,
2008
Утверждено научно-методическим советом химического факультета (27.11.2008 г., протокол № 5)
Составители: Завражнов А. Ю.,
Семенов В. Н.,
Березин С. С.,
Попов Д.Н.
Учебно-методическое пособие подготовлено на кафедре общей химии химического факультета Воронежского государственного университета.
Рекомендуется для студентов 1 курса химического факультета, обучающихся по специальности 020100 - Химическая технология, 1-го курса магистратуры, обучающихся по специальностям 020101 – Неорганическая химия, 020104 – физическая химия, 020110 – химия твердого тела, 020109 – химия, физика и механика материалов
I. ОБЩАЯ ХАРАКТЕРИСТИКА РАСТВОРОВ
Классификация растворов
Раствором называется однородная смесь, состоящая из двух или большего числа веществ, состав которой в определенных пределах может непрерывно изменяться. По степени дисперсности (т.е. измельчения веществ) компонентов различают взвеси, коллоидные и истинные растворы. Во взвесях частицы настолько велики, что видны невооруженным глазом, в коллоидных растворах для их обнаружения уже потребуется ультрамикроскоп. Наконец, в истинных растворах дробление вещества идет до мельчайших частиц – молекул, ионов, а иногда, даже до атомов – которые не обнаруживаются никакими оптическими микроскопами. По причине максимальной дисперсности эти растворы устойчивы (если нет пересыщения), прозрачны (в какой-либо области спектра), не разделяются никакими фильтрами, кроме молекулярных. В дальнейшем будем рассматривать именно истинные растворы.
В растворах часто различают растворитель и растворенное вещество. Под растворителем понимают вещество, которое имеется в растворе в большем количестве. Остальные компоненты, присутствующие в растворе в меньших количествах, называются растворенными веществами. Однако такое деление на растворитель и растворенное вещество крайне условно, особенно если количества компонентов в растворе соизмеримы.
Концентрация растворов
Важной характеристикой раствора является его состав (концентрация компонентов). Для выражения концентраций раствора применяются различные способы. Здесь мы перечислим наиболее важные из них.
1. Молярная (мольная) доля (xi) – отношение количества данного компонента к сумме числа молей всех веществ в растворе
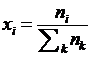 , (I.1)
, (I.1)
где ni и nk — числа молей i -ого и k -ого компонентов соответственно, где k принимает значения от 1 до числа компонентов системы. Поскольку моль – мера количества вещества, то молярную долю можно представить, как относительное содержание частиц данного сорта (неважно каких – атомов, молекул, ионов, микрогранул и т.д.) в данном веществе.
Молярная доля – безразмерная величина, заключенная в промежутке от 0 до 1. Часто также говорят о молярной доле, выраженной в %.
2. Массовая доля (wi) – отношение массы данного компонента к общей массе раствора:
 , (I.2)
, (I.2)
где mi и mk - массы i -ого и k -ого компонентов соответственно. Также как и в предыдущем случае часто говорится о массовой доле, выраженной в % (wi ×100).
В повседневной жизни мольную и массовую доли различают скорее интуитивно. Например, в надписи на бутылке “4% уксусная кислота” речь идет о массовой доле этого вещества в водном растворе. С другой стороны, когда говорят, что в такой-то группе находится 60% девушек, то, конечно же, имеют в виду “молярную долю” – никому не придет в голову взвешивать всех юношей и девушек в группе и определять массовую долю. В рамках естественных наук следует использовать только однозначные понятия.
3. Молярная концентрация (Сi) – это число молей i- ого компонента, приходящееся на единицу объема раствора.
 , (I.3)
, (I.3)
где Ni – число молей i -ого компонента, V – объем раствора.
В химической литературе молярная концентрация часто имеет размерность [моль/л] и кратко записывается как [М]. Например, надпись 1 М NaCl обозначает раствор поваренной соли концентрацией 1 моль/л и произносится как “одномолярный раствор натрий-хлор”.
Если образующие раствор компоненты неограниченно растворимы друг в друге, то говорят, что в данной системе имеется непрерывная растворимость или непрерывный ряд растворов (последний термин чаще относят к твердым растворам). Во многих случаях, однако, равновесная концентрация растворенного вещества не может превышать некоторое предельное значение, и существование растворов ограничено некоторыми областями составов (области гомогенности). Например, в системе “NaCl тверд. - H2O жидк.” при комнатной температуре и атмосферном давлении предельная растворимость хлорида натрия составляет 36,5 г на 100 г воды. В пересчете на молярные доли это дает  . Поскольку вода и насыщенный раствор NaCl полностью смешиваются друг с другом, то область гомогенности раствора поваренной соли в воде простирается от x NaCl = 0 до указанного предельного значения, соответствующего границе области гомогенности. Это означает, что выбор любых промежуточных или граничных концентраций приводит к полному самопроизвольному растворению хлорида натрия и образованию гомогенного раствора.
. Поскольку вода и насыщенный раствор NaCl полностью смешиваются друг с другом, то область гомогенности раствора поваренной соли в воде простирается от x NaCl = 0 до указанного предельного значения, соответствующего границе области гомогенности. Это означает, что выбор любых промежуточных или граничных концентраций приводит к полному самопроизвольному растворению хлорида натрия и образованию гомогенного раствора.
Растворимость различных твердых веществ в жидкостях колеблется в очень широких пределах. Например, растворимость трийодида галлия в воде составляет около 2 кг на 100 г воды. Тот же порядок растворимости (по массе) имеют некоторые соли урана (+6). С другой стороны, существует огромное количество веществ, имеющих ничтожно малую растворимость. Вместе с тем, анализ огромного количества экспериментального материала показывает, что в природе не существует полностью нерастворимых веществ. При помощи метода меченых атомов было показано, что даже сульфид ртути (+2) – одно из самых малорастворимых веществ в природе – все же способен растворяться в воде, хотя и в очень малых количествах.
Существование как, непрерывной так и ограниченной растворимости относится и к твердому состоянию вещества. В частности, небольшое количество воды растворяется в кристаллах поваренной соли (до  при обычных условиях). Таким образом, в упоминавшейся уже системе “NaCl тверд. ‑ H2O жидк.” имеется 2 ограниченных раствора: на основе воды и на основе NaCl.
при обычных условиях). Таким образом, в упоминавшейся уже системе “NaCl тверд. ‑ H2O жидк.” имеется 2 ограниченных раствора: на основе воды и на основе NaCl.
Наборы возможных фаз в двухкомпонентной системе удобно представить графически на концентрационном отрезке (рис. 1). В широкой области составов, простирающейся от x NaCl = 0,15 до x NaCl = 0,999995, рассматриваемая система оказывается гетерогенной. В ней независимо от общего состава существуют две фазы постоянного состава: насыщенный хлоридом натрия водный раствор и насыщенный водой твердый раствор на основе кристаллического NaCl. В гетерогенной области бесполезно пытаться получить в виде единственной фазы устойчивый раствор. Например, если для приготовления соляного раствора компоненты взяты в равном мольном соотношении (x NaCl= x H2O=0,5), то часть твердой соли останется в избытке. Составы, соответствующие границам областей гомогенности растворов, зависят от температуры и давления. Если влияние последнего обычно очень мало, то температура способна очень сильно менять предельную растворимость компонентов в жидких и твердых телах.

Рис. 1. Концентрационный отрезок системы H2O – NaCl для условий T = 293 K, P = 105 Па. (Устоявшееся научное название – изобарно-изотермическое сечение фазовой диаграммы системы H2O – NaCl.) Точка B отвечает границе области гомогенности водно-солевого раствора со стороны NaCl, т.е. насыщенному солью водному раствору. Также граничная точка C соответствует насыщенному твердому раствору воды в хлориде натрия. Отрезки AB и CD имеют смысл областей гомогенности ограниченных растворов (NaCl в H2O (жидк.) и H2O в NaCl (тв.) в данной системе при указанных условиях. Область гомогенности твердого раствора для наглядности многократно завышена.
Не нашли, что искали? Воспользуйтесь поиском: