
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Химические свойства кислых солей
1. Диссоциация кислых солей.
Нужно помнить: кислые соли диссоциируют по ступеням, необратимо по первой ступени (по типу сильного электролита) с образованием катионов и сложного аниона (гидроаниона, содержащего в своем составе ионы водорода  ); по всем остальным ступеням – обратимо с постепенным отщеплением ионов
); по всем остальным ступеням – обратимо с постепенным отщеплением ионов  от гидроаниона.
от гидроаниона.
1)  , 2)
, 2)  ;
;
1)  , 2)
, 2)  ;
;
1)  , 2)
, 2)  ;
;
1)  , 2)
, 2)  , 3)
, 3)  .
.
2. Кислые соли реагируют с сильными кислотами и щелочами с образованием средних или кислых солей, например:
Ca(HCO3)2 +2HCl → CaCl2 + 2H2O + 2CO2,
KHS + KOH → K2S + H2O,
KH2PO4 + KOH → K2HPO4 + H2O,
KH2PO4 + HNO3 → KNO3 + Н3PO4.
3. Многие кислые соли разлагаются при нагревании, например:
Ca(HCO3)2  CaCO3 + CO2↑ + H2O.
CaCO3 + CO2↑ + H2O.
Основные соли
Основные соли − это продукты неполного замещения гидроксогрупп в молекулах многокислотных оснований (или амфотерных гидроксидов) на кислотные остатки. В основных солях, кроме ионов метала и кислотного остатка, содержатся гидроксогруппы (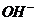 ). Основные соли образуют основания (амфотерные гидроксиды), содержащие две и более гидроксогрупп.
). Основные соли образуют основания (амфотерные гидроксиды), содержащие две и более гидроксогрупп.

|


|




 неполное замещение O – H O 2–
неполное замещение O – H O 2–

 Fe гидроксогрупп
Fe гидроксогрупп
O – H кислотными остатками H – O –  – O – S – O – Fe – O –
– O – S – O – Fe – O – 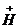

 основание
основание
(двухкислотное) + H2SO4 O


основные соли
Двухкислотное основание (или амфотерный гидроксид) образует одну нормальную и одну основную соль с данным кислотным остатком.
Трёхкислотное основание (или амфотерный гидроксид) образует одну нормальную и две основные соли с данным кислотным остатком.



 O
O
 О –N
О –N
 O
O



 + 2H – ONO2 Fe O
+ 2H – ONO2 Fe O 
 + 2HNO3 О – N
+ 2HNO3 О – N



 замещение 2 гидроксогрупп O
замещение 2 гидроксогрупп O


 O – H
O – H
Fe – O – H кислотными остатками O – H




 O – H
O – H
трёхкислотный 

 O O
O O





 амфотерный гидроксид Fe S
амфотерный гидроксид Fe S
 + H2SO4 O O
+ H2SO4 O O  .
.
O – H
основные соли
Не нашли, что искали? Воспользуйтесь поиском: