
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Химические свойства основных солей
1.Диссоциация основных солей.
Нужно помнить: основные соли диссоциируют по ступеням: по первой ступени необратимо (по типу сильного электролита) с образованием гидроксокатиона и кислотных остатков; по всем остальным ступеням обратимо с постепенным отщеплением ионов 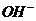 от гидроксокатиона. Примеры диссоциации основных солей:
от гидроксокатиона. Примеры диссоциации основных солей:
1ступень: 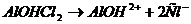 ,
,
гидроксокатион
2 ступень:  .
.
1 ступень: 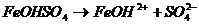 ,
,
гидроксокатион
2 ступень: 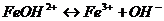 .
.
1 ступень: 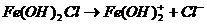 ,
,
гидроксокатион
2 ступень: 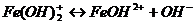 ,
,
гидроксокатион
3 ступень: 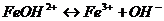 .
.
2. Основные соли летучих кислородных кислот при нагревании легко разлагаются, например:
(CuOH)2CO3  2CuО + CO2↑ + H2O.
2CuО + CO2↑ + H2O.
3. Реагируют с кислотами, например:
(MgOH)2CO3 + 2H2SO4 → 2MgSO4 + CO2 + 3H2O,
CuOHCl + HCl → CuCl2 + H2O,
FeOH(NO3)2 + HNO3 → Fe(NO3)3 + H2O.
4. Реагируют со щелочами, например:
Fe(OH)NO3 + КOH → Fe(OH)2 + КNO3. 
Двойные соли
Молекулы двойных солей состоят из ионов двух различных металлов и кислотных остатков одной и той же кислоты, например:
KAl(SO4)2 – сульфат алюминия калия;
(NH4)2Fe(SO4)2 – сульфат железа (ΙΙ) аммония;
KCuCl3 – хлорид меди (ΙΙ) калия.
Двойные соли образуются при соединении солей двух различных металлов одной и той же кислоты:
K2SO4 + Al2(SO4)3 → K2SO4 × Al2(SO4)3 → 2KAl(SO4)2,
сульфат алюминия калия
(NH4)2SO4 + Fe2(SO4)3 → (NH4)2SO4 × Fe2(SO4)3 → NH4Fe(SO4)2,
сульфат железа (ΙIΙ) аммония
Двойные соли диссоциируют в одну ступень необратимо (по типу сильного электролита) на ионы, из которых они состоят, например:
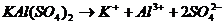 ,
,

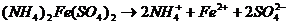 ,
,



 .
.
Смешанные соли
Смешанные соли состоят из катионов одного металла и кислотных остатков двух различных кислот и могут быть образованы при взаимодействии солей двух различных кислот одного и того же металла, например:

 CaCl2
CaCl2

 Ca(OCl)Cl + 2Ca(OCl)Cl,
Ca(OCl)Cl + 2Ca(OCl)Cl,
хлоридгипохлорит кальция Ca(ClO)2 хлоридгипохлорит кальция

 CuBr2
CuBr2

 CuBrCl + 2CuBrCl.
CuBrCl + 2CuBrCl.
 хлоридбромид меди (II) хлоридбромид меди (II)
хлоридбромид меди (II) хлоридбромид меди (II)
CuCl2
Смешанные соли диссоциируют в одну ступень необратимо (по типу сильного электролита) с образованием всех ионов, входящих в состав соли, например: 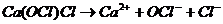 ,
,
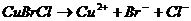 .
.
Комплексные соли
Комплексные соли состоят из сложного комплексного иона – внутренней сферы, которая в молекулярной формуле соли заключена в квадратные скобки, и внешней сферы.
Комплексные соли при диссоциации образуют сложные комплексные ионы, которые устойчивы в водных растворах:
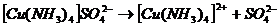 ,
,
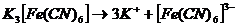 .
.
Теорию строения комплексных соединений разработал швейцарский химик А.Вернер.
Согласно теории А.Вернера в центре молекулы комплексного соединения находится центральный атом – комплексообразователь. Атомами – комплексообразователями являются атомы или ионы металлов. Наиболее сильными комплексообразователями являются атомы или ионы d- и f- элементов, затем по комплексообразующей способности располагаются атомы или ионы p- элементов, самые слабые комплексообразователи s- элементы. Вокруг центрального атома – комплексообразователя в комплексном ионе находятся противоположно заряженные ионы или нейтральные молекулы, которые называются лигандами (аддендами).
Ион – комплексообразователь и лиганды составляют внутреннюю сферу комплексного соединения, которую заключают в квадратные скобки, [ ].
Число σ-связей, образуемых центральным атомом с лигандами (аддендами) называется координационным числом центрального атома. Заряд комплексного иона равен алгебраической сумме зарядов иона – комплексообразователя и лигандов. Если лигандами являются электронейтральные молекулы, то заряд комплексного иона равен заряду комплексообразователя.
Комплексный ион может быть
– катионом:  ;
;
 ;
;
– анионом: 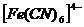 ;
;
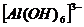 .
.
Внутренняя сфера комплексного соединения может не иметь заряда – электронейтральный комплекс: 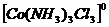 ;
;
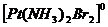 .
.
Ионы ионного комплексного соединения, не вошедшие во внутреннюю сферу, образуют внешнюю сферу. Если комплексный ион – катион, то во внешней сфере находятся анионы, например:
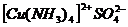 ;
;
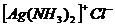 .
.
Если комплексный ион – анион, то во внешней сфере находятся катионы. Катионами обычно являются катионы щелочных и щелочноземельных металлов и катионы аммония, например:
K4[Fe(CN)6]; Na[Ag(CN)2]; NH4[AuCl4].
Рассмотрим состав комплексных солей:
K4[Fe(CN)6]
− внешняя сфера: 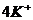
− комплексный ион – анион (или внутренняя сфера): 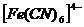
− центральный атом: 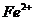
− лиганды (адденды): 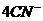
− координационное число (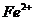 )=6.
)=6.
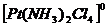
− внешняя сфера: − нет
− комплекс – электронейтральная молекула (или внутренняя сфера): 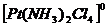
− центральный атом: 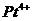
− лиганды (адденды): 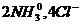
− координационное число (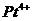 )=6.
)=6.
Названия анионных комплексных солей:
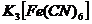
 − гексацианоферрат (III) калия;
− гексацианоферрат (III) калия;
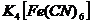 − гексацианоферрат (II) калия.
− гексацианоферрат (II) калия.
Названия катионных комплексных солей:
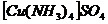 − сульфат тетраамминмеди (II);
− сульфат тетраамминмеди (II);
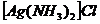 − хлорид диамминсеребра (I).
− хлорид диамминсеребра (I).
Названия электронейтральных комплексов:
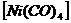 − тетракарбонилникеля (0);
− тетракарбонилникеля (0);
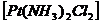 − дихлордиамминплатина (II).
− дихлордиамминплатина (II).
Не нашли, что искали? Воспользуйтесь поиском: