
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Силы Ван - дер – Ваальса
Все атомы, ионы и молекулы испытывают слабое взаимное притяжение друг к другу, котоое обусловлено стлами Ван – дер – Ваальса, однако в большинстве кристаллов эти силы очень малы по сравнению с другими силами. Такие связи встречаются у тех элементов и соединений, в которых электронная конфигурация лишь в малой степени допускает переходы электронов между атомами. Вандерваальсово притяжение является единственной силой между атомами с заполненными электронными оболочками (как это имеет место в случае инертных газов), когда нет перекрытия волновых функций электронов. Эти силы обусловлены взаимной поляризацией атомов при сближении иих друг с другом.
Поляризация создающая эти связи, обусловлена координировнным движением электронов в электронных оболочках соседних атомов. Электроны каждого из атомов смещаются относительно ядра в присутствии другого атома, т.е. атом превращается в диполь. Эта поляризация по своему характеру такова, что спообствует уменьшению энергии, и поэтому диполи притягивают друг друга и это притяжение способствует спонтанной кристаллизации. На рис эта ситуация представлена для гелия
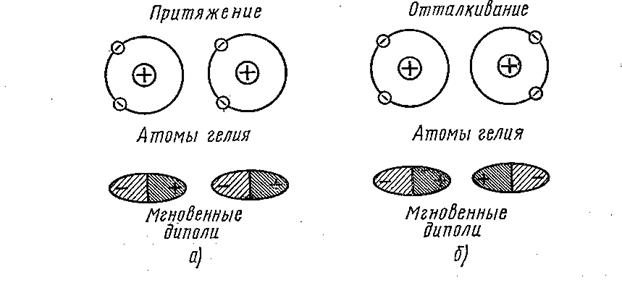
Поскольку силы Ван–дер–Ваальса слабы, то обусловленная ими энергия связи невелика и составляет несколько тысяч калорий на моль. Типичные значения этой энергии приведены в таблице.

В этой таблице не совсем правомерно приведена энергия связи жидкого гелия; она столь мала, что гелий не может образовать кристалл даже в случае самых низких достижимых сейчас температур. Этот факт даёт основание предсказать, что гелий остаётся жидким даже при абсолютном нуле температур.
Физические свойства кристаллов с чисто вандерваальсовыми связями очень просты; по электрическим свойствам они изоляторы с широкой запрещённой зоной. Они прозрачны для электромагнитого излучения вплоть до области дальнего ультрафиолета.
Ионные кристаллы
Химическая неактивность инертных газов обусловлена тем, что внешняя электронная структура их атомов, состоящая из восьми электронов, целиком, заполняющих ns – и np – подоболочки, является весьма стабильной конфигурацией. Атомы, стоящие в периодической таблице рядом с инертпыми газами, обладают склонностью принимать их конфигурацию путём отдачи или принятия электронов. У атомов щелочных металлов, стоящих непосредственно за инертными газами, валентный электрон движется вне заполненого слоя и связан с ядром слабо.
У галоидов, стоящих непосредственно перед инертными газами, недостаёт одного электрона для заполненния устойчивого слоя благородного газа. Поэтому они обладают высоким сродством к дополнительному электрону. Они будут иметь электронную структуру подобную инертным газам, если соответствующие атомы отдадут или примут несколько электронов. Например, в ионных соединениях  и
и  ионы
ионы  и
и  имеют электронную конфигурацию неона, а ионы
имеют электронную конфигурацию неона, а ионы  и
и  – электронную конфигурацию аргона. Ионная связь (её также называют полярной, гетерополярной или электровалентной) в таких соединениях является результатом электростатического притяжения разноимённо заряженных ионов. При достаточно тесном сближении ионов их внутренние оболочки приходят в соприкосновение, однако взаимного проникновения этих оболочек не происходит вследствие принципа Паули. В связи с этм возникают силы отталкивания. Связь между слами притяжения и отталкивания и энергией решётки
– электронную конфигурацию аргона. Ионная связь (её также называют полярной, гетерополярной или электровалентной) в таких соединениях является результатом электростатического притяжения разноимённо заряженных ионов. При достаточно тесном сближении ионов их внутренние оболочки приходят в соприкосновение, однако взаимного проникновения этих оболочек не происходит вследствие принципа Паули. В связи с этм возникают силы отталкивания. Связь между слами притяжения и отталкивания и энергией решётки  была установлена Борном и Майером в следующем виде
была установлена Борном и Майером в следующем виде
 ,
,
где e– заряд электрона, d – расстояние между ионами, величина A – известна под названием постоянной Маделунга и определяется кристаллической структурой соединения. Второй член этого выражения является эмпирическим: он описывает отталкивание между ионами. Кристаллическая структура, свойственная ионным соединениям в значительной степени зависит от относитедльных размеров двух ионов В структуре  ионы значительно отличаются по размерам, причём, как видно из рис. а, каждый ион натрия окружён шестью ионами хлора и в свою очередь каждый ион хлора окружён шестью ионами натрия. У соединения CsCl, оба типа ионов которого имеют близкие размеры, решётка построена таким образом, что каждый ион хлора окружён восемью ионами цезия и наоборот – рис. б.
ионы значительно отличаются по размерам, причём, как видно из рис. а, каждый ион натрия окружён шестью ионами хлора и в свою очередь каждый ион хлора окружён шестью ионами натрия. У соединения CsCl, оба типа ионов которого имеют близкие размеры, решётка построена таким образом, что каждый ион хлора окружён восемью ионами цезия и наоборот – рис. б.

Эти примеры показывают, что яисло ближайших соседей в ионных кристаллах, не является характеристикой данного типа связи. Как правило, кристаллы с преимущественно ионнымр связями отличаются высокой температурой плавления, прочностью и твёрдостью и низким коэффициентом термического расширения. Они также обладают высокопрочной межатомной связью. Поскольку все электроны в ионных кристаллах сосредоточены на орбиталях отдельных атомов, они не могут принимать участие в проводимости, и в связи сэтим ионные кристаллы являются изоляторами.
Ковалентная связь
Стабильный (ns+np) –октет электронов, характерный для инертных газов, можно получить также путём обобществления электронов, принадлежащих разным атомам. Например, у атома хлора не хватает всего одного электрона для образования стабильной конфигурации типа аргона. Следовательно, два атома хлора моеут поделить между собой два электрона,образуя молекулу хлора  .Диаграмму этого объединения можно представить в таком виде
.Диаграмму этого объединения можно представить в таком виде

Такая связь между двумя атомами известна под названием единичной ковалентной или гомеополярной. Эти два обобществлённых электрона должны иметь противоположно направденные спины, а ковалентную связь можно представить как обменное взаимодействие электронов, принадлежащих двум атомам, в результате которого возникает эффект резонанса, т.е. электроны принадлежат обоим атомам и не связаны ни с одним их них. В общем случае число единичных ковалентных связей, которые может образовать данный атом, равно числу электронов, необходимых для заполнения (ns+np) – подоболочек. Элементы, имеющие N электронов на уровнях (ns+np), будут принадлежать к N–ой группе периодической системы и, следовательно, могут принять участие в образовании (8-N) единичных ковалентных связей. Ковалентная связь характеризуется явно выраженным свойством направленности. Так в кристаллах углерода, германия и кремния в решётке алмаза каждый атом пмещается в центре тетраэдра, образованного четырьмя атомами, являющимися его ближайшими соседями. Связь осуществляется электронами на гибридных sp – орбиталях, направленных к вершинам правильного тетраэдра. Кроме того, имеет свойство насыщаемости,– оно заключается в том, что каждый атом способен образовать связь, лишь с определённым числом соседей. Кристаллы с ковалентной связью отличаются высокими температурами плавления, высокой прочностью и твёрдостью. При этом они, подобно ионным кристаллам являются изоляторами, но с более узкой запрещённой щелью.
Не нашли, что искали? Воспользуйтесь поиском: