
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Мати достатньо високу молекулярну масу; 4 страница
Чистий пероксид водню досить стійкий (0,5 % розкладу в рік при температурі З0 °С), але в присутності слідів важких металів (заліза, марганцю, свинцю) і їх іонів, під впливом радіації (особливо Уф), електричного розряду і інших чинників спостерігається спонтанний розклад пероксиду водню з виділенням тепла при температурі 25 °С:
Н2O2 → Н2О +O; O + O → O2 (1)
Реакція протікає дуже швидко по радикально-ланцюговому механізму і кінцевим продуктом реакції є молекулярний кисень:
2Н2O2 → 2Н2O + O2 (2)
Молекулярний кисень не має вибілюючої дії і в лужному середовищі при підвищеній температурі викликає значну окислювальну деструкцію целюлозного волокна. Він не встигає прореагувати з забарвленими домішками текстильного матеріалу і витрачається непродуктивно.
Крім того, при розкладі Н2О2 в системі утворюються радикали, особливо пергідроксильні НО2, які є сильними окислювачами і викликають окислювальну деструкцію волокно-утворюючих полімерів. У зв'язку з цим каталітичний розклад пероксиду водню в присутності важких металів і їх солей необхідно максимально подавляти, вводячи в систему спеціальні стабілізатори.
Торгова, технічна форма пероксиду водню: пергідроль (З0 % Н2О2) і висококонцентрована (85-90 %). Текстильна промисловість отримує пероксид у вигляді пергідролю. В технічні розчини пероксиду водню як стабілізатори вводять найчастіше фосфати.
Пероксид водню — окислювач середньої сили, його окислювальний потенціал становить 810-840 мВ.
Пероксид водню є слабкою кислотою. Як двоосновна кислота він у водному розчині дисоціює на іони:
Н2O2 → Н+ + НO2- (3)
Пергідроксиліон НО2 у результаті несиметричної будови і нерівномірності розподілу зарядів менш стійкий, ніж пероксид водню і розкладається таким чином:
НO2- ↔ -OH + O (4)
Реакція характеризує участь атомарного кисню в реакціях окислення, що, найімовірніше, пов'язано з його вибілюючою дією.
В лужному середовищі реакція (3) зсувається вправо з підвищенням концентрації нестійкого іона НО2-. Накопичення іонів НО2- в лужному середовищі характеризується реакцією:
Н2O2 + -ОН → НO2- Н2O
Крім того, в лужному середовищі змінюється характер зв'язку безпосередньо в молекулі Н2О2 - послаблюється зв'язок -О-О-:
Н
О.....О
Н
Ці дві причини обумовлюють вибілюючу дію пероксиду водню в лужному середовищі.
Але поряд з цим у лужному середовищі підсилюється реакція каталітичного розкладу пероксиду.
Таким чином, пероксид водню володіє вибілюючими властивостями за тих умов, коли він нестійкий (лужне середовище). Це викликає необхідність використання стабілізаторів при пероксидному вибілюванні. Тобто, з точки зору ефективності процесу вибілювання (руйнування забарвлених домішок), реакція розкладу (2) Н2О2 є небажаною, так як викликає деструкцію макромолекул целюлози.
Хімізм руйнування забарвлених супутників целюлози при пероксидному вибілюванні повністю не вивчений, але можна припустити, що при дії пергідроксил-іонів відбувається окислення забарвлених речовин, передусім, за системою спряжених подвійних зв'язків:
НС HC
+ НO2- → O + -ОН
HC HC
Насичення киснем і порушення внаслідок цього системи спряжених зв'язків (система спряження) спричинює знебарвлення забарвлених сполук у целюлозних волокнах. На відміну від NaClO вибілююча дія Н2О2 зумовлена тільки розвитком окислювальних процесів.
Для того, щоб процес вибілювання забезпечував гарні показники, необхідно створити умови, при яких у вибілювальному розчині містилась би необхідна кількість пергідроксил-іонів, а виділення атомарного і молекулярного кисню було зведено до мінімуму.
Для підсилення дисоціації пероксиду водню і підвищення концентрації НО2- — в розчині необхідно підвищувати рН середовища, але це одночасно викликає прискорення небажаної реакції розкладу Н2О2.
Таким чином, при створенні лужного середовища відбувається інтенсивна дисоціація Н2О2 і процес розкладу пероксиду, який можна сповільнити, вводячи в ванну стабілізатори. Найбільш поширеним стабілізатором є силікат натрію. В більшості випадків на фабриках використовують два продукти: технічне рідке скло і метасилікат натрію у вигляді кристалогідрату Nа2SiO3 9Н20.
Відомо, що при відсутності стабілізатора процес вибілювання відбувається нерівномірно, спостерігається значне пошкодження целюлози (утворюється оксицелюлоза).
Процес стабілізації — адсорбційний процес. При гідролізі силікату натрію утворюється колоїдна речовина — свіжо-висаджений осад гелю кремнієвої кислоти з високо розвинутою поверхнею:
Na2SiO3 + 2Н2О ↔ 2NaOH + Н2SіО3
Кремнегель характеризується високими адсорбційними властивостями і здатний поглинати продукти розкладу пероксиду водню, переводячи їх у неактивну форму. Каталітичний розклад Н2О2 протікає по радикально-ланцюговому механізму. Н2Sі03, адсорбуючи радикали, сповільнює реакцію, обриває зростання ланцюга.
Крім того, кремнегель адсорбує (зв'язує) каталізатори розкладу пероксиду водню, сповільнюючи реакцію (висувається припущення хімічної взаємодії стабілізатора з каталізаторами розкладу пероксиду водню).
Таким чином, стабілізуюча дія силікату натрію обумовлена комплексом властивостей, які дозволяють йому діяти відразу по декількох механізмах. Він може утворювати проміжні сполуки з каталізаторами, зв'язувати вільні радикали в розчині, іммобілізовувати (зв'язувати) каталізатори, адсорбуючи їх на високо розвинутій поверхні золя кремнієвої кислоти, в яку він переходить в водних системах.
Силікат натрію в певній кількості містить зв'язаний луг Nа2SіO2 nNаОН і здатний проявляти буферні властивості, створюючи деякий резерв лугу в системі без підвищення ступеня лужної активації пероксиду водню, тому він є своєрідним депо лугу, необхідна кількість якого (для активації пероксиду) виділяється із силікату в міру використання лугу на взаємодію з волокном.
Водночас силікат натрію здатний проявляти каталітичну дію на розклад пероксиду, який протікає не по радикально-ланцюговому механізму, а через проміжні продукти (пероксосилікати натрію). Але стабілізуюча дія силікату суттєво переважає каталітичну. Солі кальцію і магнію, які присутні у воді, відіграють роль стабілізаторів пероксиду водню, подавляючи каталітичну активність силікату натрію шляхом переводу його в солі кальцію і магнію. Останні сприяють випадінню осаду у ванні, що спричинює підвищення зольності, ламкості і жорсткості тканини.
Утворення нерозчинного осаду із силікату натрію в умовах вибілювання також пов'язано з його дегідратацією при високій температурі. Утворюється своєрідний кремнієвміщуючий полімер сітчатої (тривимірної) структури, що є причиною його нерозчинності у воді.
Утворений осад у вигляді твердих і щільних горбистих утворень закріплюється на внутрішніх поверхнях обладнання, особливо на нижніх частинах запарних апаратів і є причиною пошкодження тканин (утворення надирів). Видалити його зі стінок апаратів дуже важко.
Тому виникає задача повної або хоча б часткової заміни силікату натрію. З метою попередження пошкодження тканини у вибілюючий розчин додають невелику кількість (0,2 г/л) тринатрійфосфату (Nа3РО4), що сприяє утворенню осаду SіО2 в тонко дисперсному стані, який меншою мірою випадає в осад на стінках апарата і легко видаляється промиванням.
Науковцями Московського державного текстильного університету запропонований препарат ОЕДФ (гідроксиетилидендифосфонова кислота), який ефективно розчиняє силікатні осади, попереджає їх утворення.
Пошук ефективних стабілізаторів, у яких відсутні недоліки силікату натрію (утворення твердого полімерного осаду), поки що не дав позитивних результатів.
Незважаючи на вищевказаний недолік, силікат натрію не має конкурентів зі стабілізуючої дії.
Як показала практика, найбільш ефективним способом попередження утворення осаду кремнієвої кислоти є заміна рідкого силікату метасилікатом (Nа2SіО3 9Н2О).
Метасилікат — це кристалічний порошок, добре розчинний у воді. В ньому міститься менше кремнієвої кислоти, ніж у рідкому силікаті. Метасилікат, крім того, менш схильний до гідролізу і майже не утворює важковидаляючого осаду на обладнанні.
Зупинимось на технології пероксидного вибілювання. Одним із найбільш важливих параметрів процесу вибілювання є рН вибілювального розчину. Кислі і нейтральні розчини пероксиду водню малопридатні для практичного використання.
Аналіз залежності ефективності вибілювання і окислювальної деструкції целюлози від рН свідчить, що оптимальним значенням є рН 10-11, при якому вибілювання відбувається досить ефективно і волокно не руйнується.
Вибілювання бавовняних тканин пероксидом водню проводиться в лужному середовищі ще й тому, що в цих умовах відбувається не тільки окислювальна деструкція забарвлених домішок, але й додаткове до відварювання видалення залишків домішок, розчинених у лужному середовищі.
Вибілювання пероксидом водню проводять періодичним і безперервним способами.
Періодичне вибілювання здійснюється в котлах після операції лужного відварювання. Температура вибілювання 90 °С, тривалість — до 3-х годин. Найбільш поширені безперервні способи вибілювання. Існує багато варіантів апаратурного оформлення безперервної технології, але всі вони зводяться до набору основних операцій: 1) просочування вибілюючим розчином пероксиду з добавками допоміжних речовин (стабілізатори, змочувачі), 2) віджимання обробленої тканини (100 %-ний приріст), 3) теплова обробка тканини в запарних камерах (насичена пара, пара під тиском) і 4) промивання водою.
Просочувальна ванна, як правило, містить, г/л:
H2O2 - 3-5;
Na2SiO3 - 9-12;
NaOH - 3-4;
ПАР - 5
Найбільш важливою частиною ліній для вибілювання тканин є запарні камери, конструкція яких повинна забезпечити достатньо тривале (30—60 хв.) перебування в ній тканини при високій продуктивності ліній (100-150 м/хв.). Ці умови визначають функцію запарної камери як ємного депо, в якому накопичуються достатньо великі запаси тканини в формі джгута або широкого полотна.
На рис. 2.2. приведені схеми запарних камер різних типів. Сапожкову запарну камеру використовують для джгутової обробки і вибілювання широким полотном; конвеєрну, рулоноперемотувальну, камеру високотемпературного безперервного запарювання — тільки для вибілювання широким полотном.
Сучасні безперервні способи вибілювання текстильних матеріалів здійснюються при високих швидкостях руху тканини (100-150 м/хв.) на вибілювальних лініях, де проводяться всі основні операції: 1) розшліхтовування, 2) лужне відварювання, 3) кислування, 4) вибілювання, 5) промивання і 6) висушування. У вибілювальних лініях можна виділити дві основні частини: у першій проводяться суміщені операції розшліхтовування і відварювання, промивання і кислування, в другій — вибілювання, промивання і висушування. В першій частині лінії тканині надається стійка і висока гігроскопічність, у другій — стійка і висока білизна і додаткова гігроскопічність.
Відварювання тканини здійснюється в лужних варильних розчинах, а вибілювання може проводитись пероксидним або хлоритними розчинами.
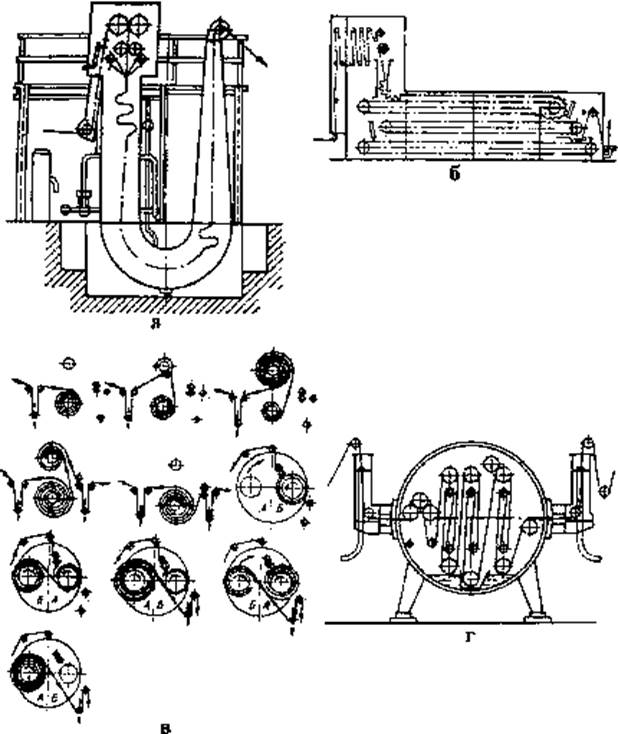
Рис. 2.2. Схеми запарних камер різних типів:
а — сапожкова; б — конвеєрна; в — рулоноперемотувальна;
Не нашли, что искали? Воспользуйтесь поиском: