
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ. ЗАДАЧА 1. Содержание водорода ω(Н) в водородном соединении азота NHx составляет 17.75 %
ЗАДАЧА 1. Содержание водорода ω(Н) в водородном соединении азота NHx составляет 17.75 %. Определить молярную массу эквивалента азота.
Дано: ω(Н) = 17,75 %
____________________
Найти: M ( N).
N).
____________________
Решение.
* Если в условиях задания не оговорено значение какой-то величины, то при определенных условиях, можно задаться любым ее значением.
Мы привыкли пользоваться таким приемом: приняв массу вещества за 100г и используя значение массовой доли элемента в соединении, находим требуемые величины, например, массу, а затем количество вещества каждого из компонентов. Такой прием удобен, если в задаче известна формула вещества (т. е  в данном случае валентность азота), однако нахождение валентности азота как раз и является вопросом этой задачи. Поэтому постараемся подобрать условие, приближающее нас к «области» понятия эквивалента. Итак,
в данном случае валентность азота), однако нахождение валентности азота как раз и является вопросом этой задачи. Поэтому постараемся подобрать условие, приближающее нас к «области» понятия эквивалента. Итак,
Возьмем не 100г, а1 моль эквивалента этого гидрида, т.е. пусть n ( NHx) = 1 моль. Тогда масса гидрида будет равна его молярной массе эквивалента (ведь молярная масса и есть масса одного моля):
NHx) = 1 моль. Тогда масса гидрида будет равна его молярной массе эквивалента (ведь молярная масса и есть масса одного моля):
m( NHx ) = M ( NHx)
NHx)  n (
n ( NHx) = M (
NHx) = M ( NHx)
NHx)  1 = M (
1 = M ( NHx),
NHx),
а масса водорода тоже будет равна его молярной массе эквивалента, т.к количества вещества элементов, входящих в состав бинарного соединения равны количеству вещества эквивалента этого соединения и равны между собой:
n ( H) = n (
H) = n ( NHx) = 1;
NHx) = 1;
 m( H )=M (
m( H )=M ( H)
H)  n (
n ( H) = M (
H) = M ( H)
H)  1 = M (
1 = M ( H).
H).
Тогда, воспользовавшись определением массовой доли элемента в соединении, получим:
ω(Н) =  =
= 
Напомним, что z атома водорода в любом соединении равно 1, т.к. он не имеет никакой другой валентности, кроме единицы. И
M ( H) =
H) =  =
= 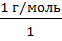 = 1 г/моль
= 1 г/моль
Подставив значения величин ω(Н) и M ( H), в формулу для ω(Н), получим:
H), в формулу для ω(Н), получим:
M ( NHx)
NHx)  =
=  = 5,63 г/моль.
= 5,63 г/моль.
Мы получили значение молярной массы эквивалента бинарного соединения. Теперь, чтобы найти молярную массу эквивалента азота, вспомним, что молярная масса эквивалента бинарного соединения равна сумме молярных масс эквивалентов атомов, входящих в его состав. Для нашего вещества
M ( NHx) = M (
NHx) = M ( N) + M (
N) + M ( H),
H),
и найти M ( N) теперь не составит труда:
N) теперь не составит труда:
M ( N) = M (
N) = M ( NHx) - M (
NHx) - M ( H) = 5,63г/моль - 1г/моль = 4,63г/моль
H) = 5,63г/моль - 1г/моль = 4,63г/моль
ЗАДАЧА 2. При восстановлении оксида меди массой 8,0 г выделилось
1,8 г воды. Определить: молярную массу эквивалента меди и массовый состав оксида меди.
Дано: m (CuхOу) = 8,0 г, m (Н2O) = 1,8 г
Найти: M( Cu), w(Cu)
Cu), w(Cu)
_______________________
Решение.
Запишем схему реакции: CuхOу + уH2 = уH2O + хCu
Выберем вещество, по которому возможно найти количество вещества эквивалента n ( Х). Для него должно быть известны масса m и молярная масса эквивалента M(
Х). Для него должно быть известны масса m и молярная масса эквивалента M( Х),. Массы известны и для оксида меди, и для воды. Но только для Н2О мы сможем рассчитать M(
Х),. Массы известны и для оксида меди, и для воды. Но только для Н2О мы сможем рассчитать M( Х), потому что сможем найти ее эквивалентное число z. Т.к. реакция в задаче – окислительно-восстановительная, найдем z (Н2О) из уравнения электронного баланса:
Х), потому что сможем найти ее эквивалентное число z. Т.к. реакция в задаче – окислительно-восстановительная, найдем z (Н2О) из уравнения электронного баланса:
Н2 - 2e- = 2 Н+
z (Н2О) = 2, т.к. в ней содержатся 2 атома Н.
M( Н2О) =
Н2О) = 
n( Н2О) =
Н2О) = 
Воспользуемся законом эквивалентов:
n( CuхOу) = n (
CuхOу) = n ( Н2О) = 0,2 моль
Н2О) = 0,2 моль
M( CuxОy) =
CuxОy) = 
Теперь можно найти молярную массу эквивалента меди, воспользовавшись следствием из закона эквивалентов (13):
M( Cu) = M(
Cu) = M( CuxОy) - M(
CuxОy) - M( О)
О)
Т.к. M( О) =
О) =  ,
,
получаем
M( Cu) = 40 г/моль – 8 г/моль = 32 г/моль
Cu) = 40 г/моль – 8 г/моль = 32 г/моль
Для нахождения массовой доли меди в соединении воспользуемся формулой, которую мы вывели для нее в прошлой задаче:
ω(Н) = 
Не нашли, что искали? Воспользуйтесь поиском: