
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
СЛЕДСТВИЯ ИЗ ЗАКОНА ЭКВИВАЛЕНТОВ
Одним из соотношений, вытекающих из закона эквивалентов, является следующее: для бинарного соединения AхBу молярная масса эквивалента складывается из молярных масс эквивалента элементов, составляющих соединение, вне зависимости от индексов, с которыми элементы входят в состав соединения. То есть если для расчета обычной молярной массы необходимо знать точный количественный состав соединения:
М(AхBу) = х ∙ М(A) + у ∙ М(B), (12)
то для расчета молярной массы эквивалента знание количественного состава соединения необязательно:
М(  AхBу) = М(
AхBу) = М(  A) + М(
A) + М(  B). (13)
B). (13)
Для остальных (не бинарных) соединений молярную массу эквивалента можно рассчитать как сумму молярных масс эквивалента катиона и аниона, опять же вне зависимости от индексов в формуле. Например, молярная масса эквивалента соли МехВу, рассчитывается так:
М( МехВу) = М(
МехВу) = М( Меу+) + М(
Меу+) + М( Bх-), (14)
Bх-), (14)
а молярные массы эквивалента катиона металла Ме и аниона кислотного остатка В рассчитываются как
М( Меу+) =
Меу+) =  и М(
и М( Bх-) =
Bх-) =  , (15)
, (15)
где z(Меу+) и z(Вх-) – эквивалентные числа катиона металла и аниона кислотного остатка, равные численно их зарядам у и х.
Пример 7. Расчитать молярные массы эквивалента соединений: Na2O, Na OH, H2SO4, Na2SO4.
Решение.
1) М( Na2O) = М(
Na2O) = М( Na+) + М(
Na+) + М( O-2) =
O-2) =  +
+  =
= 
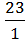 +
+  23+8 = 31 г/моль
23+8 = 31 г/моль
2) 2) М( NaOН) = М(
NaOН) = М( Na+) + М(
Na+) + М( OН-) =
OН-) =  +
+  =
=  +
+  23+17 = 40 г/моль
23+17 = 40 г/моль
3) М( Н2SO4) = М(
Н2SO4) = М( +) + М(
+) + М( O42-) =
O42-) =  +
+  =
=  +
+  1+48 = 49 г/моль
1+48 = 49 г/моль
4) М( Na2SO4) = М(
Na2SO4) = М( +) + М(
+) + М( O42-) =
O42-) =  +
+  =
=  +
+  23+48 = 71 г/моль
23+48 = 71 г/моль
Не нашли, что искали? Воспользуйтесь поиском: