
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
ЗАДАЧА 4. При восстановлении 11,2 г оксида железа водородом израсходовано 4,70 л (н. у.) водорода. Определить простейшую формулу оксида железа.
Дано: m(FexOy) = 11,2 г, V(H2) = 18,42 л
____________________
Найти: формулу FexOy
____________________
Решение.
Как и в предыдущем примере, для решения задачи необходимо рассчитать степень окисления атома железа, равную его эквивалентному числу:
z(Fe) = 
Как всегда, начнем с расчета n ( ). Его можно рассчитать по водороду:
). Его можно рассчитать по водороду:
Н2 - 2e- = 2 Н+
z (Н2) = 2
n ( H2) =
H2) =  0,419 моль
0,419 моль
По закону эквивалентов
n( Fe) = n(
Fe) = n( H2) = 0,419 моль
H2) = 0,419 моль
Рассчитаем M ( FeхOу) =
FeхOу) =  26,7 г/моль,
26,7 г/моль,
Т.к M( FeхOу) = M(
FeхOу) = M( Fe) + M(
Fe) + M( O)
O)
и M( О)= M(
О)= M( О) =
О) =  ,
,
M( Fe) = M(
Fe) = M( FexОy) - M(
FexОy) - M( О) =26,7г/моль ‒ 8г/моль = 18,7г/моль.
О) =26,7г/моль ‒ 8г/моль = 18,7г/моль.
Наконец,
z(Fe) =  =
=  = 3
= 3
Формула оксида железа - Fe2O3.
ЗАДАЧА 5. Определить формулу соединения NxHy, если при сжигании 40г вещества образовалось 44,96 г воды.
Дано: m(NxHy) = 11,2 г
m (H2O) = 44,96 г
____________________
Найти: формулуNxHy
____________________
Решение.
NxHy + O2 = N2 + H2O
Находим количество вещества эквивалента по воде:
n( Н2О) = 2 . n(H2O) =
Н2О) = 2 . n(H2O) =  4,995 моль
4,995 моль
По закону эквивалентов количество вещества эквивалента n( NxHy) тоже равно 4,995 моль.
NxHy) тоже равно 4,995 моль.
Т.к. нам дана масса не чистого азота, а всего соединения, найдем сначала молярную массу эквивалента этого соединения:
M( NxHy) =
NxHy) =  =
= 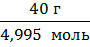 = 8,0 г/моль
= 8,0 г/моль
M ( N) = M(
N) = M( NxHy) - M(
NxHy) - M( Н)=8 – 1 = 7г/моль.
Н)=8 – 1 = 7г/моль.
Степень окисления атома азота будет равна его эквивалентному числу z z (N) =  =
=  = 2
= 2
Степень окисления азота -2; формула исходного соединения N2H4 (фрагмент NH2 существовать не может).
Не нашли, что искали? Воспользуйтесь поиском: