
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Задания для самостоятельной работы
Опишите молекулы методом валентных связей. Укажите тип гибридизации, расположение орбиталей в пространстве и форму молекул: BF3; COCl2; SO2;SO3; CCl4 ; SiH4; NH3; NH4+; [BF4]-; H2S; PBr3; PCl5; SCl6.
Ответы: sp2- плоский треугольник; sp2- плоский треугольник; sp2- уголковая ( ے ~1200); sp2- плоский треугольник; sp3-тетраэдр; sp3-тетраэдр; sp3-тригональная пирамида; sp3-тетраэдр; sp3-тетраэдр; sp3-уголковая ( ے ~1090); sp3-тригональная пирамида; sp3d -тригональная бипирамида; sp3d2- октаэдр.
МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ – ЛИНЕЙНОЙ КОМБИНАЦИИ АТОМНЫХ ОРБИТАЛЕЙ
В основе теории молекулярных орбиталей(МО) лежит представление о том, что атомы в значительной мере меняют свою электронную конфигурацию при образовании химической связи. В общем случае метод МО рассматривает образование химических связей как результат движения всех электронов в суммарном поле, созданном всеми электронами и всеми ядрами исходных атомов. При образовании молекулы атомные орбитали преобразуются в так называемым молекулярные орбитали. Они отличаются от исходных атомных орбиталей как формой, так и энергией. Энергетические и пространственные характеристики молекулярных орбиталей рассчитываются аналогично характеристикам атомных орбиталей отдельного атома – решается уравнение Шредингера. Но вместо атомной волновой функции уравнение Шредингера решается для молекулярной волновой функции, которая выражается как линейная комбинация атомных. Отсюда возникло название метода молекулярных орбиталей – линейной комбинации атомных орбиталей (МО - ЛКАО).
Поскольку число линейных комбинаций равно числу компонентов, участвующих в них, из двух атомных орбиталей атомов А и В - φ(А) и φ(В)- возникает две молекулярные Ψ1 и Ψ2:
Ψ1 = с1 ∙ φ(А) + с2 ∙ φ(В)
Ψ2 = с1 ∙ φ(А) ‒ с2 ∙ φ(В),
где с1 и с2 – коэффициенты.
Первая из молекулярных орбиталей – сумма атомных - ниже по энергии, чем обе исходные атомные. Форма ее такова, что максимум электронной плотоности находится между двумя ядрами, и если электроны находятся на ней, ядра атомов притягиваются по направлению друг к другу. Эта орбиталь называется связывающей. Обозначается по типу связи: σ.

Вторая орбиталь – разность двух атомных - выше по энергии, чем исходные, а максимум электронной плотности находится по обе стороны от межъядерного пространства. Нахождение электронов на этой орбитали вызывает притяжение ядер атомов в разные стороны, т.е. разрыв молекулы. Такая орбиталь называется разрыхляющей (обозначается σ*).

Образование молекулярных орбиталей из атомных изображается на энергетической диаграмме, затем орбитали заполняются электронами с соблюдением всех принципов квантовой механики. Например, схема заполнения молекулярных орбиталей молекулы водорода строится так: сначала на диаграмме изображают атомные орбитали двух атомов (с двух разных сторон), между ними располагают молекулярные орбитали. Связывающие орбитали называются по типу связи – σ. Связывающие орбитали обозначают σ, а разрыхляющие – σ*. Затем молекулярные орбитали заполняют имеющимися в системе электронами снизу вверх (принцип минимума энергии), с соблюдением запрета Паули и правила Хунда. Электронов в такой системе всего 2.
Н2

Кратность связи Рim равна числу электронных пар на связывающих орбиталях минус число электронных пар на разрыхляющих, или:
Рim =  ,
,
где Ne(св) Ne (разр) – число электронов на связывающих и разрыхляющих орбиталях соответственно.
Для молекулы водорода Рim (Н2)= 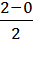 = 1.
= 1.
Магнитные свойства молекулы или иона определяются наличием или отсутствием неспаренных электронов. В молекуле Н2 неспаренных электронов на молекулярных орбиталях нет, и она диамагнитна.
Не2

Поскольку каждый атом гелия имеет по два электрона на валентном уровне, электронов в системе будет четыре, а кратность связи в молекуле
Рim (Не2) =  = 0. Нулевая кратность связи означает, то, что связи нет, и это согласуется с действительностью: молекула Не2 не существует. Однако эксперминтальные данные подтверждают возможность существования молекулярного иона (Не2)+. Объяснить его существование можно, вычислив кратность связи в этом ионе. На молекулярных орбиталях данного иона будут находиться не 4, а 3 электрона, причем 1 электрон уйдет с более высокой по энергии, разрыхляющей орбитали: Рim (Не2+) =
= 0. Нулевая кратность связи означает, то, что связи нет, и это согласуется с действительностью: молекула Не2 не существует. Однако эксперминтальные данные подтверждают возможность существования молекулярного иона (Не2)+. Объяснить его существование можно, вычислив кратность связи в этом ионе. На молекулярных орбиталях данного иона будут находиться не 4, а 3 электрона, причем 1 электрон уйдет с более высокой по энергии, разрыхляющей орбитали: Рim (Не2+) = 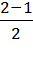 = 1/2. Связь, кратность которой равна 1/2, слабее, чем одинарная (чем больше кратность связи, тем она сильнее, и тем меньше ее длина). Но зато молекулярный ион Не2+ хотя бы может существовать.
= 1/2. Связь, кратность которой равна 1/2, слабее, чем одинарная (чем больше кратность связи, тем она сильнее, и тем меньше ее длина). Но зато молекулярный ион Не2+ хотя бы может существовать.
N2
На диаграмме изображаем только атомные орбитали валентного слоя.

Из восьми атомных орбиталей атомов азота получили восемь молекулярных, которые заполняются десятью электронами внешнего уровня. Шесть р-орбиталей дают три связывающие и три разрыхляющие орбитали. Первая МО по типу связи называется σр, две следующие – π. Аналогично называются разрыхляющие орбитали - σр* и две π*. Поскольку все электроны спарены, молекула N2 диамагнитна. Кратность связи Рim (N2) =  = 3.
= 3.
О2

Начиная с атома О молекулярные орбитали  р становятся ниже по энергии, чем π –МО. р - электронов в системе 8, они располагаются на пяти МО: три из них связывающие, две более высокие по энергии – разрыхляющие (π*, π*). В соответствии с правилом Хунда два электрона распределяются на две орбитали (так суммарный спин больше). Из-за наличия этих неспаренных электронов молекула кислорода обладает парамагнитными свойствами. Кратность связи Рim (О2) =
р становятся ниже по энергии, чем π –МО. р - электронов в системе 8, они располагаются на пяти МО: три из них связывающие, две более высокие по энергии – разрыхляющие (π*, π*). В соответствии с правилом Хунда два электрона распределяются на две орбитали (так суммарный спин больше). Из-за наличия этих неспаренных электронов молекула кислорода обладает парамагнитными свойствами. Кратность связи Рim (О2) =  = 2.
= 2.
CO
Поскольку энергии электронных орбиталей разных атомов имеют различные значения, не все АО могут комбинировать, образуя МО. Так обстоит дело для молекулы СО. 2s -подуровень атома С далек по энергии от 2s – подуровня атома О, так что они не комбинируют. Поскольку 2s- орбитальатома кислорода не образует комбинации ни с одной другой орбиталью, ее энергия остается неизменной, и среди молекулярных орбиталей она называется несвязывающей, поскольку действительно не вносит вклада ни в связывание (как связывающие), ни в разрыв молекулы (как разрыхляющие орбитали). А вот 2р- орбиталиатома кислорода могут комбинировать и с 2s, и с 2р- орбиталями атома С. Правда, поскольку комбинируют семь АО, из них образуется и семь МО: три - ниже по энергии (связывающие), три – выше (разрыхляющие), а еще одна остается без пары и является еще одной несвязывающей орбиталью с неизмененной энергией. Поскольку в расчете кратности связи учитываются только электроны на связывающих и разрыхляющих орбиталях, кратность связи в молекуле СО Рim (СО) =  = 3.
= 3.
Энергетическая диаграмма молекулы СО выглядит так:

Т.к. все электроны спарены, молекула СО диамагнитна.
Не нашли, что искали? Воспользуйтесь поиском: