
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Генетическая связь между классами неорганических соединений.
 | |||
 |
|
|


Взаимодействует с

(+1, +2) (+5, +6, +7)
Ме+nO-2 HeMeO-2 (Me+nO-2)
2. Кислотными 2. Основными
 оксидами оксидами
оксидами оксидами
 | |||
| |||
|
Ме активный Основа- кроме
Кисло- I– IA, IA гр. ниями SiO2
тами (кроме Ве, Mg)
|
|
|




Ме+n(OH)n-1 HR
Раствор. солями MeR Ме до Н (разб.
если образуется (↓) НСl, H2SO4)
 3. 3.
3. 3.

Кислот.2. 4. Нерасвор. Осн. 2. 4. Солями
 оксидами осн-я (t) оксидами слабых и
оксидами осн-я (t) оксидами слабых и
летучих
Кислотами!1. 5. Амфот.! 1. кислот
осн-я Осн-ми

 Кислотами
Кислотами
 Основаниями
Основаниями
Осн-ми (см. Т.Р.)
 2.
2.
Ме (см. ряд 1. 3. Кислотами
напряжений)
4.
Солями, с обр. (↓)

РЕШЕНИЕ ТИПОВОЙ ЗАДАЧИ ПО ТЕМЕ:
«КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ»
Задача №1.
1. А) напишите молекулярные и ионные уравнения, протекающие между H2SO4 и веществами: 1) NaOH, 2) Fe, 3) CuO, 4) SO2, 5) NaCl;
Б) составьте уравнения реакций, протекающих в цепи превращений:
Fe → FeO → FeSO4 → Fe(OH)2 → FeO → Fe;
В) составьте уравнения всех реакций, протекающих между веществами H3PO4 и NaOH;
Г) назовите перечисленные ниже соединения и определите класс – Ca(HCO3)2, FeСl3, CuOHCl, H3BO3, Cu2O, K2CrO4, H2F2, P2O5.
Решение:
А 1) 1. Выберем вещества, с которыми взаимодействуют кислоты, помня:


 Ме до Н
Ме до Н
(НСl, разб. H2SO4)
3.
 |
Осн. 2. 4. Солями
оксидами слабых и
летучих
! 1. кислот
Осн-ми
 |
Отсюда следует, что H2SO4 взаимодействует: с NaOH, Fe, CuO.
2. Составляем молекулярное уравнение реакции:
H2SO4 + 2 NaOH → Na2SO4 + 2 H2O.
3. Составляем ионное уравнение реакции, зная п. 5 данной темы:
а) полное ионное уравнение
2 H+ + SO42- + 2 Na+ + 2 OH‾ → 2 Na+ + SO42- + 2 H2O;
сокращаем в полном ионном уравнении частицы
2 H+ + SO42- + 2 Na+ + 2 OH‾ → 2 Na+ + SO42- + 2 H2O;
б) и получаем краткое ионное уравнение
2 H+ + 2 OH‾ → 2 H2O.
А 2) 1) H2SO4 + Fe → FeSO4 + H2
а) 2H++SO42-+Fe→Fe2++SO42-+H2
б) 2H++Fe→Fe2++H2
А 3) 1) H2SO4 + CuO → CuSO4 + H2O
а) 2H++SO42-+СuO→Cu2++SO42-+H2O
б) 2H++CuO→Cu2++H2O
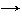 Б) 1) 2 Fe + O2 t˚ 2 FeO;
Б) 1) 2 Fe + O2 t˚ 2 FeO;
2) FeO +H2SO4 → FeSO4 + H2O;
3) FeSO4 + 2 NaOH → Fe(OH)2 + Na2SO4;
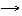 4) Fe(OH)2 t˚ FeO + H2O;
4) Fe(OH)2 t˚ FeO + H2O;
 5) FeO + C t˚ Fe + CO.
5) FeO + C t˚ Fe + CO.
В) Реакция взаимодействия кислоты (H3PO4) с основанием (NaOH) может протекать в разных количественных соотношениях:
 1) H3PO4 + 3NaOH Na3PO4 + 3 H2O; полная нейтрализация
1) H3PO4 + 3NaOH Na3PO4 + 3 H2O; полная нейтрализация
ортофосфат натрия

 2) H3PO4 + 2NaOH Na2HPO4 + 2 H2O;
2) H3PO4 + 2NaOH Na2HPO4 + 2 H2O;
гидроортофосфат натрия неполная нейтрализация
 3) H3PO4 + NaOH NaH2PO4 + H2O.
3) H3PO4 + NaOH NaH2PO4 + H2O.
дигидроортофосфат натрия
Это реакции нейтрализации, т.к. в результате образуются соли и вода (H/OH). При полной нейтрализации (1:3) образуется нормальная соль.
При неполной нейтрализации (1:2) и (1:1) образуются кислые соли.
Г) Сa(HCO3)2 – гидрокарбонат кальция (кислая соль).
FeCl3 – хлорид железа (III) нормальная соль
CuOHCl – гидроксохлорид меди (II) (основная соль)
H3BO3 – борная кислота (кислота)
Cu2O – оксид меди (I) (основной оксид)
K2CrO4 – хромат калия (соль нормальная)
H2F2 – димер плавиковой кислоты (кислота)
P2O5 –оксид фосфора (V)(кислотный оксид)
Не нашли, что искали? Воспользуйтесь поиском: