
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Электронная структура многоэлектронных атомов
Таблица 2
| 1. Принцип минимальной энергии: Электроны в атоме заполняют тот подуровень, где меньше запас энергии. |
| 2. Правило Клечковского: Увеличение энергии и заполнение орбиталей происходит в порядке возрастания суммы квантовых чисел (n+ l), а при равной сумме в порядке уменьшения числа nи увеличения числа l. Реальная электронная схема: 1s2<2s2<2p6<3s2<3p6<4s2<3d10<4p6<5s2<4d10<5p6<4s2<5d1<4f14<5d9<6p6<7s2<6d1<5f14<6d9<7p6 Исключение составляют элементы, у которых наблюдается провал электронов (медь, серебро, золото, хром, молибден, ниобий, рутений, родий, палладий, платина) |
Продолжение таблицы 2
3. Принцип Паули: В атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел.
 Следствие: В любой атомной орбитали может быть только два электрона с противоположными спинами ↑↓! Следствие: В любой атомной орбитали может быть только два электрона с противоположными спинами ↑↓!
|
| 4. Правило Гунда: Электроны в пределах подуровня занимают максимальное число атомных орбиталей, но так чтобы их суммарный спин был максимальный. P3 ↑ ↑ ↑ 1/2 1/2 1/2 Σ=1,5 |
| 5. Все химические элементы делят на семейства: s, p, d, f, в зависимости, какой подуровень заполняется в атоме последним. |
| 6. Валентные электроны – это электроны участвующие в образовании химических связей. Валентные электроны расположены: у s – элементов в s орбиталях последнего Э.У. – ns у p – элементов в s и p орбиталях последнего Э.У. np ns у d – элементов в d орбиталях предпоследнего и s последнего Э.У. ns (n-1)d |
| 7. Возбуждение атома возможно при условиях: а) наличие в атоме спаренных электронов, б) наличие свободных А.О., в) при возбуждении электроны распариваются – переходят с одного подуровня на другой только в пределах последнего Э.У. |
8. Химические элементы делятся:
Металлы Неметаллы
80 % 20 %
s,p,d,f s,p
1.R ат. > 1. R ат. 1. R ат. <
   2. Мало (е)-1,2,3 2. Число (е) на 2. Много (е)-4,5,6,7
посл. Э.У. 2. Мало (е)-1,2,3 2. Число (е) на 2. Много (е)-4,5,6,7
посл. Э.У.
 3. К отдаче (е) 3. Выражена 3. К принятию (е)
тенденция 3. К отдаче (е) 3. Выражена 3. К принятию (е)
тенденция
  Ме0-n(e)→Ме+n неМе0+n(e)→неМе-n
вос-ль окисление ок-ль восстановление Ме0-n(e)→Ме+n неМе0+n(e)→неМе-n
вос-ль окисление ок-ль восстановление
|
Продолжение таблицы 2
| 9. Степень окисления – условный заряд атома, вычисленный из предположения, что атом отдает либо принимает электроны. Ме проявляют только положительные степени окисления (С.О.). Высшая (С.О.) равна № группы. Исключения: IВ-(Cu,Ag,Au), VIIIB-(Fe,Co,Ni). |
| 10. НеМе проявляют, как отрицательные (низшие (С.О.))=№ группы – 8, так и положительные (С.О.)=№ группы. Исключения: VIA(O), VIIA(F). |
| 11. Генетическая связь между классами неорганических веществ I. Ме→Ме(+1,+2)+nО-2→Ме+n(ОН)-1n Металл основной оксид основание II. неМе→не МеО-2(Ме+5,+6,+7О-2)→HR Неметалл кислотный оксид кислота |
РЕШЕНИЕ ТИПОВОЙ ЗАДАЧИ ПО ТЕМЕ: «СТРОЕНИЕ АТОМА»
Проанализируйте с точки зрения строения атома элемент с порядковым № 12.
Алгоритм.
а) найдем положение химического элемента в П.С. Д.И. Менделеева и составим электронную формулу, воспользовавшись реальной электронной схемой. см. табл.2 (п.2) и сделаем вывод: указав семейство и тип элемента. (см. п.5 и п.8)
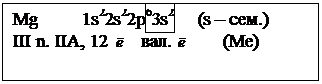 |
б) Графически изобразим валентные электроны в нормальном и возбужденном состояниях (см. п.6 и п.7)
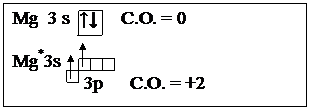 |
в) Укажем окислительно-восстановительные свойства атома, помня, что это металл (см. п.8)
|
г) Исходя из числа неспаренных электронов в нормальном и возбужденном состояниях, укажем устойчивые С.О. (см. п.9 или п.10)
|
д) Приведем примеры соединений в устойчивых степенях окисления (простое вещество, оксиды и гидроксиды см. п.11)
Mg0, Mg+2O
е) Укажем характер оксидов и гидроксидов (см.п.11)
|
Не нашли, что искали? Воспользуйтесь поиском:
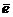 → Mg+2 (ок-с)
вос-ль
→ Mg+2 (ок-с)
вос-ль