
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
ТЕМА 3. КОВАЛЕНТНАЯ ХИМИЧЕСКАЯ СВЯЗЬ
1. Ковалентная связь – это связь за счёт общих электронных пар.
Н · + · Н → Н: Н
2. Механизмы образования:
а) обменный б) донорно-акцепторный
А · + · В → А: В А: + ڤВ → А: В
3. По способам перекрывания атомных орбиталей (А.О.) различают:
Связь π-связь
перекрываются А.О. по линии связи перекрываются А.О. перпендикулярно ядер (лобовое перекрывание). линии связи ядер (боковое перекрыва-
ние).
Особенности:Особенности:
1) σ-связь первичная 1) π-связь вторичная
2) Еσ – высокая => прочная 2) Еπ > Еσ =>слабая
3) σ-локализованная. 3) π-нелокализованная.
! Ковалентная связь строго направлена.
! Направленность зависит от типа гибридизации центрального атома в молекуле.
Гибридизация (смешение) - изменение первоначальной формы А.О. и образование новых А.О., но совершенно одинаковой формы. => Выигрыш энергии, т.к. связи за счёт гибридных А.О. более прочные.
Таблица 3
Тип гибридизации и геометрия частицы.
| Тип гиб-риди-зации | А.О. участвующие в гибридизации | Число Г.А.О. | Положение Г.А.О. отно-сительно ядра центрального атома | Геометрия частицы |
                     1. sp 1. sp
| + s p | 2 ГАО sp | 180º | Σ σ σ линейная |
                                  2. sp2 2. sp2
| + p s p | 3 ГАО sp2 | 120˚ | Треугольная Σ σ σ угловая |
                               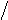     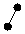                3. sp3 3. sp3
| + p s p p | 4 ГАО sp3 | 109˚28' | Тетраэдр Пирамида Угловая |
                                                  4. sp3d 4. sp3d
| + p s p d p | 5 ГАО sp3d | y z x | Тетраго- Нальная Пирамида Плоский квадрат |
                                    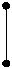                              5. sp3d2 5. sp3d2
| + + s p d p p d | 6 ГАО sp3d2 | y z x | Октаэдр |
РЕШЕНИЕ ТИПОВОЙ ЗАДАЧИ ПО ТЕМЕ: «ХИМИЧЕСКАЯ СВЯЗЬ»
Определить тип гибридизации и геометрию молекулы Н2О.
Алгоритм.
1. Найдём центральный атом (ц.а.) в молекуле – тот атом, степень окисления которого выше независимо от знака.
1. Н2+О-2 => ц.а. – О (ст.ок.) = -2 => в атоме 2 неспаренных ē.
2. Определим число периферийных атомов (Н) – координационное число (к.ч.), которое указывает на число σ-связей.
 |

 2. К.ч.(О) = 2 => 2 σ-связи. σ О σ Н
2. К.ч.(О) = 2 => 2 σ-связи. σ О σ Н
Н
3. Составим графическое изображение валентных электронов ц.а. в соответствующей степени окисления.


 8О 1s2 2s22p4
8О 1s2 2s22p4
IIп. IVA вал. 
2p
| ↑↓ | ↑ | ↑ | |
| ↑↓ | |||
 2s
2s
4. Определим тип гибридизации, помня, что в гибридизации участвуют только те валентные А.О., которые образуют σ-связи (орбитали с неспаренными электронами, а также орбитали со спаренными электронами последнего энергетического уровня (Э.У.). На графическом изображении, пользуясь правилом 4 отсечём соответствующие А.О.
 |

| ↑ | ↑ |
2p
2s Тип гибридизации sp3
2 σ
 | |||
 |
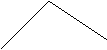
5. Изобразим гибридизацию рисунком (см. табл. п.3).
 |








 р ↑↓
р ↑↓


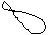




 + p → → O
+ p → → O




 p
p

 ↑↓
↑↓
 | |||||
 | |||||
 |

 6. Покажем перекрывание А.О. ц.а. – О – с переферийными атомами – Н (помня, что от него в образовании связей участвуют 1s1орбитали.
6. Покажем перекрывание А.О. ц.а. – О – с переферийными атомами – Н (помня, что от него в образовании связей участвуют 1s1орбитали.
 |
↑↓
↑↓ H
H
7. Изобразим геометрию частицы (см. табл.1 п.3).
 |
↑↓ 

 O
O
↑↓
H H
Угловая молекула
 |
 ТЕМА 4. ЭНЕРГЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
ТЕМА 4. ЭНЕРГЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
 |
| Термохимия – изучает тепловые эффекты химических реакций (первый и второй законы термодинамики) | Тепловой эффект химической реакции – тепло, которое выделяется или поглощается в данной химической реакции. | Система – всякий материальный объект, состоящий из большого числа частиц и обособленный от окружающей среды физическими или воображаемыми границами. |

 Первый закон термодинамики:
Первый закон термодинамики:
“Тепло, сообщаемое системе (Q) расходуется на изменение её внутренней энергии (DU) и на совершение работы против сил внешнего давления (А).
|
|
,где А = р *DV Þ
 |
Система перешла из состояния 1 в состояние 2
|
| ||||
 | |||||

 состояние 1 состояние 2
состояние 1 состояние 2
начальное конечное
 |
Химические реакции
Изобарные (р – const) Изохорные (V – const)


 1 (U1, V1, p – const) 1 (U1, V – const) DV = 0
1 (U1, V1, p – const) 1 (U1, V – const) DV = 0

 2 (U2, V2, p – const) 2 (U2, V – const)
2 (U2, V2, p – const) 2 (U2, V – const)
|
сгруппируем относительно
1-ого и 2-ого состояния
Qp = (U2 + p *V2) – (U1 + p *V1)
U + p *V = H (энтальпия)
Теплосодержание системы
Qp = H2 – H1, QР = DH Qv = DU
ВЫВОД: тепловой эффект химической реакции равен
 изменению энтальпии системы изменению внутренней энергии
изменению энтальпии системы изменению внутренней энергии
системы.
! Таких реакций больше.
 |
 Термохимические уравнения характеризуют признаками:
Термохимические уравнения характеризуют признаками:
а) отражено фазовое состояние (г., ж., тв.);
б) возможны дробные коэффициенты;
в) коэффициенты показывают число моль реагирующих и образующихся веществ;
г)указывается тепловой эффект
 |  |
 Экзотермические Эндотермические
Экзотермические Эндотермические
Не нашли, что искали? Воспользуйтесь поиском: