
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Расчет изменения энтропии для различных процессов
Термодинамические расчеты изменения энтропии основаны на определении (4.6) и на свойствах частных производных энтропии по термодинамическим параметрам:
 (4.8)
(4.8)
Последние два тождества представляют собой соотношения Максвелла (вывод см. в гл. 5).
1) Нагревание или охлаждение при постоянном давлении.
Количество теплоты, необходимое для изменения температуры системы, выражают с помощью теплоемкости:  Q обр = Cp dT.
Q обр = Cp dT.
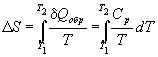 (4.9)
(4.9)
Если теплоемкость не зависит от температуры в интервале от T 1 до T 2, то уравнение (4.8) можно проинтегрировать:
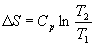 . (4.10)
. (4.10)
Если изменение температуры происходит при постоянном объеме, то в формулах (4.9) и (4.10) Cp надо заменить на C V.
2) Изотермическое расширение или сжатие.
Для расчета энтропии в этом случае надо знать уравнение состояния системы. Расчет основан на использовании соотношения Максвелла:
 (4.11)
(4.11)
В частности, для изотермического расширения идеального газа (p = nRT / V)
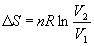 (4.12)
(4.12)
Этот же результат можно получить, если использовать выражение для теплоты изотермического обратимого расширения идеального газа: Q обр = nRT ln(V 2/ V 1) .
3) Фазовые переходы.
При обратимом фазовом переходе температура остается постоянной, а теплота фазового перехода при постоянном давлении равна  H фп, поэтому изменение энтропии равно:
H фп, поэтому изменение энтропии равно:
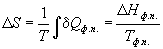 (4.13)
(4.13)
При плавлении и кипении теплота поглощается, поэтому энтропия в этих процессах возрастает: S тв < S ж < S г. При этом энтропия окружающей среды уменьшается на величину  S ф.п., поэтому изменение энтропии Вселенной равно 0, как и полагается для обратимого процесса в изолированной системе.
S ф.п., поэтому изменение энтропии Вселенной равно 0, как и полагается для обратимого процесса в изолированной системе.
4) Смешение идеальных газов при постоянных температуре и давлении.
Если n 1 молей одного газа, занимающего объем V 1, смешиваются с n 2 молями другого газа, занимающего объем V 2, то общий объем будет равен V 1 + V 2, причем газы расширяются независимо друг от друга и общее изменение энтропии равно сумме изменений энтропии каждого газа:
 , (4.14)
, (4.14)
где xi - мольная доля i -го газа в полученной газовой смеси. Изменение энтропии (4.14) всегда положительно, т.к. все ln xi < 0, поэтому идеальные газы всегда смешиваются необратимо.
Если при тех же условиях смешиваются две порции одного и того же газа, то уравнение (4.14) уже неприменимо. Никаких изменений в системе при смешивании не происходит, и  S = 0. Тем не менее, формула (4.14) не содержит никаких индивидуальных параметров газов, поэтому, казалось бы, должна быть применима и к смешению одинаковых газов. Это противоречие называют парадоксом Гиббса.
S = 0. Тем не менее, формула (4.14) не содержит никаких индивидуальных параметров газов, поэтому, казалось бы, должна быть применима и к смешению одинаковых газов. Это противоречие называют парадоксом Гиббса.
Не нашли, что искали? Воспользуйтесь поиском: