
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Коллигативные свойства растворов. Растворимость
Свойства разбавленных растворов, зависящие только от количества нелетучего растворенного вещества, называются коллигативными свойствами. К ним относятся понижение давление пара растворителя над раствором, повышение температуры кипения и понижение температуры замерзания раствора, а также осмотическое давление.
Понижение температуры замерзания и повышение температуры кипения раствора по сравнению с чистым растворителем:
 T зам. = = K К. m 2,
T зам. = = K К. m 2,
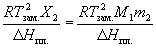
 T кип. =
T кип. = 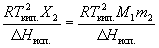 = K Э. m 2.
= K Э. m 2.
где m 2 – моляльность раствора, K К и K Э – криоскопическая и эбулиоскопическая постоянные растворителя, X 2 – мольная доля растворенного вещества,  H пл. и
H пл. и  H исп. – энтальпии плавления и испарения растворителя, Tпл . и Tкип . – температуры плавления и кипения растворителя, M 1 – молярная масса растворителя.
H исп. – энтальпии плавления и испарения растворителя, Tпл . и Tкип . – температуры плавления и кипения растворителя, M 1 – молярная масса растворителя.
Осмотическое давление  в разбавленных растворах можно рассчитать по уравнению
в разбавленных растворах можно рассчитать по уравнению
 =
= 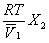 ,
,
где X 2 – мольная доля растворенного вещества, 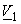 – мольный объем растворителя. В очень разбавленных растворах это уравнение преобразуется в уравнение Вант-Гоффа:
– мольный объем растворителя. В очень разбавленных растворах это уравнение преобразуется в уравнение Вант-Гоффа:
 = CRT,
= CRT,
где C – молярность раствора.
Уравнения, описывающие коллигативные свойства неэлектролитов, можно применить и для описания свойств растворов электролитов, введя поправочный коэффициент Вант-Гоффа i, например:
 = iCRT или
= iCRT или  T зам. = iK К. m 2.
T зам. = iK К. m 2.
Изотонический коэффициент связан со степенью диссоциации  электролита:
электролита:
i = 1 +  (
( – 1),
– 1),
где  – количество ионов, образующихся при диссоциации одной молекулы.
– количество ионов, образующихся при диссоциации одной молекулы.
Растворимость твердого вещества в идеальном растворе при температуре T описывается уравнением Шредера:
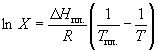 ,
,
где X – мольная доля растворенного вещества в растворе, T пл. – температура плавления и  H пл. – энтальпия плавления растворенного вещества.
H пл. – энтальпия плавления растворенного вещества.
ПРИМЕРЫ
Пример 8-1. Рассчитать растворимость висмута в кадмии при 150 и 200o C. Энтальпия плавления висмута при температуре плавления (273o C) равна 10.5 кДж. моль–1. Считать, что образуется идеальный раствор и энтальпия плавления не зависит от температуры.
Решение. Воспользуемся формулой 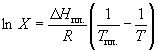 .
.
При 150o C 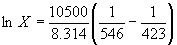 , откуда X = 0.510
, откуда X = 0.510
При 200o C 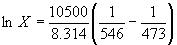 , откуда X = 0.700
, откуда X = 0.700
Растворимость увеличивается с температурой, что характерно для эндотермического процесса.
Пример 8-2. Раствор 20 г гемоглобина в 1 л воды имеет осмотическое давление 7.52  10–3 атм при 25oC. Определить молярную массу гемоглобина.
10–3 атм при 25oC. Определить молярную массу гемоглобина.
Решение.
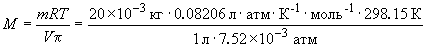 = 65 кг. моль–1.
= 65 кг. моль–1.
ЗАДАЧИ
1. Рассчитать минимальную осмотическую работу, совершаемую почками для выделения мочевины при 36.6o C, если концентрация мочевины в плазме 0.005 моль. л–1, а в моче 0.333 моль. л–1.
2. 10 г полистирола растворено в 1 л бензола. Высота столбика раствора (плотностью 0.88 г. см–3) в осмометре при 25o C равна 11.6 см. Рассчитать молярную массу полистирола.
3. Белок сывороточный альбумин человека имеет молярную массу 69 кг. моль–1. Рассчитать осмотическое давление раствора 2 г белка в 100 см3 воды при 25o C в Па и в мм столбика раствора. Считать плотность раствора равной 1.0 г. см–3.
4. При 30oC давление пара водного раствора сахарозы равно 31.207 мм рт. ст. Давление пара чистой воды при 30oC равно 31.824 мм рт. ст. Плотность раствора равна 0.99564 г. см–3. Чему равно осмотическое давление этого раствора?
5. Плазма человеческой крови замерзает при –0.56oC. Каково ее осмотическое давление при 37oC, измеренное с помощью мембраны, проницаемой только для воды?
6. *Молярную массу фермента определяли, растворяя его в воде и измеряя высоту столбика раствора в осмометре при 20o C, а затем экстраполируя данные к нулевой концентрации. Получены следующие данные:
| C, мг. см–3 | 3.211 | 4.618 | 5.112 | 6.722 |
| h, см | 5.746 | 8.238 | 9.119 | 11.990 |
7. Рассчитать молярную массу фермента.
8. Молярную массу липида определяют по повышению температуры кипения. Липид можно растворить в метаноле или в хлороформе. Температура кипения метанола 64.7oC, теплота испарения 262.8 кал. г–1. Температура кипения хлороформа 61.5oC, теплота испарения 59.0 кал. г–1. Рассчитайте эбулиоскопические постоянные метанола и хлороформа. Какой растворитель лучше использовать, чтобы определить молярную массу с максимальной точностью?
9. Рассчитать температуру замерзания водного раствора, содержащего 50.0 г этилен-гликоля в 500 г воды.
10. Раствор, содержащий 0.217 г серы и 19.18 г CS2, кипит при 319.304 К. Температура кипения чистого CS2 равна 319.2 К. Эбулиоскопическая постоянная CS2 равна 2.37 К. кг. моль–1. Сколько атомов серы содержится в молекуле серы, растворенной в CS2?
11. 68.4 г сахарозы растворено в 1000 г воды. Рассчитать: а) давление пара, б) осмотическое давление, в) температуру замерзания, г) температуру кипения раствора. Давление пара чистой воды при 20oC равно 2314.9 Па. Криоскопическая и эбулиоскопическая постоянные воды равны 1.86 и 0.52 К. кг. моль–1 соответственно.
12. Раствор, содержащий 0.81 г углеводорода H(CH2)nH и 190 г бромистого этила, замерзает при 9.47oC. Температура замерзания бромистого этила 10.00oC, криоскопическая постоянная 12.5 К. кг. моль–1. Рассчитать n.
13. При растворении 1.4511 г дихлоруксусной кислоты в 56.87 г четыреххлористого углерода точка кипения повышается на 0.518 град. Температура кипения CCl4 76.75oC, теплота испарения 46.5 кал. г–1. Какова кажущаяся молярная масса кислоты? Чем объясняется расхождение с истинной молярной массой?
14. Некоторое количество вещества, растворенное в 100 г бензола, понижает точку его замерзания на 1.28oC. То же количество вещества, растворенное в 100 г воды, понижает точку ее замерзания на 1.395oC. Вещество имеет в бензоле нормальную молярную массу, а в воде полностью диссоциировано. На сколько ионов вещество диссоциирует в водном растворе? Криоскопические постоянные для бензола и воды равны 5.12 и 1.86 К. кг. моль–1.
15. Рассчитать идеальную растворимость антрацена в бензоле при 25o C в единицах моляльности. Энтальпия плавления антрацена при температуре плавления (217o C) равна 28.8 кДж. моль–1.
16. Рассчитать растворимость п -дибромбензола в бензоле при 20 и 40o C, считая, что образуется идеальный раствор. Энтальпия плавления п -дибромбензола при температуре его плавления (86.9o C) равна 13.22 кДж. моль–1.
17. Рассчитать растворимость нафталина в бензоле при 25o C, считая, что образуется идеальный раствор. Энтальпия плавления нафталина при температуре его плавления (80.0o C) равна 19.29 кДж. моль–1.
18. Рассчитать растворимость антрацена в толуоле при 25o C, считая, что образуется идеальный раствор. Энтальпия плавления антрацена при температуре плавления (217o C) равна 28.8 кДж. моль–1.
19. Рассчитать температуру, при которой чистый кадмий находится в равновесии с раствором Cd – Bi, мольная доля Cd в котором равна 0.846. Энтальпия плавления кадмия при температуре плавления (321.1o C) равна 6.23 кДж. моль–1.
Не нашли, что искали? Воспользуйтесь поиском: