
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Химическое равновесие
Химическим равновесием называется такое состояние обратимой химической реакции
a A + b B = c C + d D,
при котором с течением времени не происходит изменения концентраций реагирующих веществ в реакционной смеси. Состояние химического равновесия характеризуется константой химического равновесия:
 , (9.1)
, (9.1)
где Ci – концентрации компонентов в равновесной идеальной смеси.
Константа равновесия может быть выражена также через равновесные мольные доли Xi компонентов:
 . (9.2)
. (9.2)
Для реакций, протекающих в газовой фазе, константу равновесия удобно выражать через равновесные парциальные давления Pi компонентов:
 . (9.3)
. (9.3)
Для идеальных газов Pi = CiRT и Pi = XiP, где P – общее давление, поэтому KP, KC и KX связаны следующим соотношением:
KP = KC (RT) c+d–a–b = KXP c+d–a–b. (9.4)
Константа равновесия связана с  rG o химической реакции:
rG o химической реакции:
 (9.5)
(9.5)
 (9.6)
(9.6)
Изменение  rG или
rG или  rF в химической реакции при заданных (не обязательно равновесных) парциальных давлениях Pi или концентрациях Ci компонентов можно рассчитать по уравнению изотермы химической реакции (изотермы Вант-Гоффа):
rF в химической реакции при заданных (не обязательно равновесных) парциальных давлениях Pi или концентрациях Ci компонентов можно рассчитать по уравнению изотермы химической реакции (изотермы Вант-Гоффа):
 . (9.7)
. (9.7)
 . (9.8)
. (9.8)
Согласно принципу Ле Шателье, если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие сместится так, чтобы уменьшить эффект внешнего воздействия. Так, повышение давления сдвигает равновесие в сторону уменьшения количества молекул газа. Добавление в равновесную смесь какого-либо компонента реакции сдвигает равновесие в сторону уменьшения количества этого компонента. Повышение (или понижение) температуры сдвигает равновесие в сторону реакции, протекающей с поглощением (выделением) теплоты.
Количественно зависимость константы равновесия от температуры описывается уравнением изобары химической реакции (изобары Вант-Гоффа)
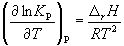 (9.9)
(9.9)
и изохоры химической реакции (изохоры Вант-Гоффа)
 . (9.10)
. (9.10)
Интегрирование уравнения (9.9) в предположении, что  rH реакции не зависит от температуры (что справедливо в узких интервалах температур), дает:
rH реакции не зависит от температуры (что справедливо в узких интервалах температур), дает:
 (9.11)
(9.11)
 (9.12)
(9.12)
где C – константа интегрирования. Таким образом, зависимость ln K P от 1 /Т должна быть линейной, а наклон прямой равен –  rH / R.
rH / R.
Интегрирование в пределах K 1, K 2, и T 1, T 2 дает:
 (9.13)
(9.13)
 (9.14)
(9.14)
По этому уравнению, зная константы равновесия при двух разных температурах, можно рассчитать  rH реакции. Соответственно, зная
rH реакции. Соответственно, зная  rH реакции и константу равновесия при одной температуре, можно рассчитать константу равновесия при другой температуре.
rH реакции и константу равновесия при одной температуре, можно рассчитать константу равновесия при другой температуре.
ПРИМЕРЫ
Пример 9-1. Рассчитать константу равновесия для реакции
CO(г) + 2H2(г) = CH3OH(г)
при 500 K.  fGo для CO(г) и CH3OH(г) при 500 К равны –155.41 кДж. моль–1 и –134.20 кДж. моль–1 соответственно.
fGo для CO(г) и CH3OH(г) при 500 К равны –155.41 кДж. моль–1 и –134.20 кДж. моль–1 соответственно.
Решение.  Go реакции:
Go реакции:
 rGo =
rGo =  fGo (CH3OH) –
fGo (CH3OH) –  fGo (CO) = –134.20 – (–155.41) = 21.21 кДж. моль–1.
fGo (CO) = –134.20 – (–155.41) = 21.21 кДж. моль–1.
 = 6.09
= 6.09  10–3.
10–3.
Пример 9-2. Константа равновесия реакции
N2(г) + 3H2(г) = 2NH3(г)
равна K P = 1.64  10–4 при 400o C. Какое общее давление необходимо приложить к эквимолярной смеси N2 и H2, чтобы 10% N2 превратилось в NH3? Газы считать идеальными.
10–4 при 400o C. Какое общее давление необходимо приложить к эквимолярной смеси N2 и H2, чтобы 10% N2 превратилось в NH3? Газы считать идеальными.
Решение. Пусть прореагировало  моль N2. Тогда
моль N2. Тогда
| N2(г) | + | 3H2(г) | = | 2NH3(г) | |
| Исходное количество | |||||
| Равновесное количество | 1– 
| 1–3 
| 2  (Всего: 2–2 (Всего: 2–2  ) )
| ||
| Равновесная мольная доля: | 
| 
| 
|
Следовательно, K X =  и KP = KX. P –2 =
и KP = KX. P –2 =  .
.
Подставляя  = 0.1 в полученную формулу, имеем
= 0.1 в полученную формулу, имеем
1.64  10–4 =
10–4 = 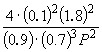 , откуда P = 51.2 атм.
, откуда P = 51.2 атм.
Пример 9-3. Константа равновесия реакции
CO(г) + 2H2(г) = CH3OH(г)
при 500 K равна K P = 6.09  10–3. Реакционная смесь, состоящая из 1 моль CO, 2 моль H2 и 1 моль инертного газа (N2) нагрета до 500 K и общего давления 100 атм. Рассчитать состав равновесной смеси.
10–3. Реакционная смесь, состоящая из 1 моль CO, 2 моль H2 и 1 моль инертного газа (N2) нагрета до 500 K и общего давления 100 атм. Рассчитать состав равновесной смеси.
Решение. Пусть прореагировало  моль CO. Тогда
моль CO. Тогда
| CO(г) | + | 2H2(г) | = | CH3OH(г) | |
| Исходное количество: | |||||
| Равновесное количество: | 1– 
| 2–2 
| 
| ||
| Всего в равновесной смеси: | 3–2  моль компонентов + 1 моль N2 = 4–2 моль компонентов + 1 моль N2 = 4–2  моль моль
| ||||
| Равновесная мольная доля | 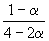
| 
| 
|
Следовательно, K X =  и KP = KX. P–2 =
и KP = KX. P–2 =  .
.
Таким образом, 6.09  10–3 =
10–3 =  .
.
Решая это уравнение, получаем  = 0.732. Соответственно, мольные доли веществ в равновесной смеси равны:
= 0.732. Соответственно, мольные доли веществ в равновесной смеси равны:  = 0.288,
= 0.288,  = 0.106,
= 0.106,  = 0.212 и
= 0.212 и  = 0.394.
= 0.394.
Пример 9-4. Для реакции
N2(г) + 3H2(г) = 2NH3(г)
при 298 К K P = 6.0  105, а
105, а  fHo (NH3) = –46.1 кДж. моль–1. Оценить значение константы равновесия при 500 К.
fHo (NH3) = –46.1 кДж. моль–1. Оценить значение константы равновесия при 500 К.
Решение. Стандартная мольная энтальпия реакции равна
 rHo = 2
rHo = 2  fHo (NH3) = –92.2 кДж. моль–1.
fHo (NH3) = –92.2 кДж. моль–1.
Согласно уравнению (9.14),  =
=
= ln (6.0  105) +
105) +  = –1.73, откуда K 2 = 0.18.
= –1.73, откуда K 2 = 0.18.
Отметим, что константа равновесия экзотермической реакции уменьшается с ростом температуры, что соответствует принципу Ле Шателье.
ЗАДАЧИ
Указание: во всех задачах считать газы идеальными.
1. При 1273 К и общем давлении 30 атм в равновесной смеси
CO2(г) + C(тв) = 2CO(г)
содержится 17% (по объему) CO2. Сколько процентов CO2 будет содержаться в газе при общем давлении 20 атм? При каком давлении в газе будет содержаться 25% CO2?
2. При 2000oC и общем давлении 1 атм 2% воды диссоциировано на водород и кислород. Рассчитать константу равновесия реакции
H2O(г) = H2(г) + 1/2O2(г) при этих условиях.
3. Константа равновесия реакции
CO(г) + H2O(г) = CO2(г) + H2(г)
при 500oC равна Kp = 5.5. Смесь, состоящая из 1 моль CO и 5 моль H2O, нагрели до этой температуры. Рассчитать мольную долю H2O в равновесной смеси.
4. Константа равновесия реакции
N2O4(г) = 2NO2(г)
при 25oC равна Kp = 0.143. Рассчитать давление, которое установится в сосуде объемом 1 л, в который поместили 1 г N2O4 при этой температуре.
5. Сосуд объемом 3 л, содержащий 1.79  10–2 моль I2, нагрели до 973 K. Давление в сосуде при равновесии оказалось равно 0.49 атм. Считая газы идеальными, рассчитать константу равновесия при 973 K для реакции
10–2 моль I2, нагрели до 973 K. Давление в сосуде при равновесии оказалось равно 0.49 атм. Считая газы идеальными, рассчитать константу равновесия при 973 K для реакции
I2 (г) = 2I (г).
6. Для реакции
PCl5(г) = PCl3(г) + Cl2(г)
при 250oC  rG o = –2508 Дж. моль–1. При каком общем давлении степень превращения PCl5 в PCl3 и Cl2 при 250o C составит 30%?
rG o = –2508 Дж. моль–1. При каком общем давлении степень превращения PCl5 в PCl3 и Cl2 при 250o C составит 30%?
7. Для реакции
2HI(г) = H2(г) + I2(г)
константа равновесия K P = 1.83  10–2 при 698.6 К. Сколько граммов HI образуется при нагревании до этой температуры 10 г I2 и 0.2 г H2 в трехлитровом сосуде? Чему равны парциальные давления H2, I2 и HI?
10–2 при 698.6 К. Сколько граммов HI образуется при нагревании до этой температуры 10 г I2 и 0.2 г H2 в трехлитровом сосуде? Чему равны парциальные давления H2, I2 и HI?
8. Сосуд объемом 1 л, содержащий 0.341 моль PCl5 и 0.233 моль N2, нагрели до 250oC. Общее давление в сосуде при равновесии оказалось равно 29.33 атм. Считая все газы идеальными, рассчитать константу равновесия при 250oC для протекающей в сосуде реакции
PCl5 (г) = PCl3 (г) + Cl2(г)
9. Константа равновесия реакции
CO(г) + 2H2(г) = CH3OH(г)
при 500 K равна K P = 6.09  10–3. Рассчитать общее давление, необходимое для получения метанола с 90% выходом, если CO и H2 взяты в соотношении 1: 2.
10–3. Рассчитать общее давление, необходимое для получения метанола с 90% выходом, если CO и H2 взяты в соотношении 1: 2.
10. При 25oC  fGo (NH3) = –16.5 кДж. моль–1. Рассчитать
fGo (NH3) = –16.5 кДж. моль–1. Рассчитать  rG реакции образования NH3 при парциальных давлениях N2, H2 и NH3, равных 3 атм, 1 атм и 4 атм соответственно. В какую сторону реакция будет идти самопроизвольно при этих условиях?
rG реакции образования NH3 при парциальных давлениях N2, H2 и NH3, равных 3 атм, 1 атм и 4 атм соответственно. В какую сторону реакция будет идти самопроизвольно при этих условиях?
11. Экзотермическая реакция
CO(г) + 2H2(г) = CH3OH(г)
находится в равновесии при 500 K и 10 бар. Если газы идеальные, как повлияют на выход метанола следующие факторы: а) повышение T; б) повышение P; в) добавление инертного газа при V = const; г) добавление инертного газа при P = const; д) добавление H2 при P = const?
12. Константа равновесия газофазной реакции изомеризации борнеола (C10H17OH) в изоборнеол равна 0.106 при 503 K. Смесь 7.5 г борнеола и 14.0 г изоборнеола поместили в сосуд объемом 5 л и выдерживали при 503 K до достижения равновесия. Рассчитать мольные доли и массы борнеола и изоборнеола в равновесной смеси.
13. Равновесие в реакции
2NOCl(г) = 2NO(г) + Cl2(г)
устанавливается при 227oC и общем давлении 1.0 бар, когда парциальное давление NOCl равно 0.64 бар (изначально присутствовал только NOCl). Рассчитать  rGo для реакции. При каком общем давлении парциальное давление Cl2 будет равно 0.10 бар?
rGo для реакции. При каком общем давлении парциальное давление Cl2 будет равно 0.10 бар?
14. Рассчитать общее давление, которое необходимо приложить к смеси 3 частей H2 и 1 части N2, чтобы получить равновесную смесь, содержащую 10% NH3 по объему при 400oC. Константа равновесия для реакции
N2(г) + 3H2(г) = 2NH3(г)
при 400oC равна K = 1.60  10–4.
10–4.
15. При 250oC и общем давлении 1 атм PCl5 диссоциирован на 80% по реакции
PCl5 (г) = PCl3 (г) + Cl2(г).
Чему будет равна степень диссоциации PCl5, если в систему добавить N2, чтобы парциальное давление азота было равно 0.9 атм? Общее давление поддерживается равным 1 атм.
16. При 2000oC для реакции
N2(г) + O2(г) = 2NO(г)
K p = 2.5  10–3. В равновесной смеси N2, O2, NO и инертного газа при общем давлении 1 бар содержится 80% (по объему) N2 и 16% O2. Сколько процентов по объему составляет NO? Чему равно парциальное давление инертного газа?
10–3. В равновесной смеси N2, O2, NO и инертного газа при общем давлении 1 бар содержится 80% (по объему) N2 и 16% O2. Сколько процентов по объему составляет NO? Чему равно парциальное давление инертного газа?
17. Рассчитать стандартную энтальпию реакции, для которой константа равновесия
а) увеличивается в 2 раза, б) уменьшается в 2 раза при изменении температуры от 298 К до 308 К.
18. Оксид ртути диссоциирует по реакции
2HgO(тв) = 2Hg(г) + O2(г).
При 420oC давление газов равно 5.16  104 Па, а при 450oC 10.8
104 Па, а при 450oC 10.8  104 Па. Рассчитать константы равновесия при этих температурах и энтальпию диссоциации на моль HgO.
104 Па. Рассчитать константы равновесия при этих температурах и энтальпию диссоциации на моль HgO.
19. Для реакции
Ag2CO3(тв) = Ag2O(тв) + CO2(г)
получены следующие данные по зависимости константы равновесия от температуры:
| T, K | ||||
| K P | 3.98  10–4 10–4
| 1.41  10–2 10–2
| 1.86  10–1 10–1
| 1.48 |
Определить стандартную энтальпию реакции в этом температурном интервале.
20. Зависимость константы равновесия реакции 2C3H6(г) = C2H4(г) + C4H8(г) от температуры между 300 К и 600 К описывается уравнением
ln K = –1.04 –1088 / T +1.51  105 / T 2.
105 / T 2.
Рассчитать  rGo,
rGo,  rHo и
rHo и  rSo реакции при 400 К.
rSo реакции при 400 К.
ЛИТЕРАТУРА
ГЛАВА 1
1. Полторак О.М. Термодинамика в физической химии. – М.: Высшая школа, 1991.
2. Эткинс П. Физическая химия. – М.: Мир, 1980. Т. 1, гл. 1 – 6. Atkins P. Physical Chemistry. 5th edition. – Oxford Univ. Press, 1994, ch. 1 – 5.
3. Даниэльс Ф., Альберти Р. Физическая химия. – М.: Высшая школа, 1967, гл. 1 – 5.
4. Горшков В.И., Кузнецов И.А. Основы физической химии. – М.: Изд-во Моск. ун-та, 1993.
5. Базаров И.П. Термодинамика. – М.: Высшая школа, 1991.
6. Еремин В.В., Каргов С.И., Кузьменко Н.Е. Реальные газы. – М.: Хим. ф-т МГУ, 1998.
7. Киселева Е.В., Каретников Г.С., Кудряшов И.В. Сборник примеров и задач по физической химии. – М.: Высшая школа, 1976.
8. Картушинская А.И., Лельчук Х.А., Стромберг А.Г. Сборник задач по химической термодинамике. – М.: Высшая школа, 1973.
ГЛАВА 2
1. Даниэльс Ф., Олберти Р. Физическая химия. – М.: Мир, 1978.
2. Эткинс П. Физическая химия. – М.: Мир, 1980.
3. Горшков В.И., Кузнецов И.А. Основы физической химии. – М.: Издательство Моск. ун-та, 1993.
4. Казанская А.С., Скобло В.А. Расчеты химических равновесий. – М.: Высшая школа, 1974.
5. Киселева Е.В., Каретников Г.С., Кудряшов И.В. Сборник примеров и задач по физической химии. – М.: Высшая школа, 1976.
6. Уильямс В., Уильямс Х. Физическая химия для биологов. – М.: Мир, 1976.
7. Чанг Р. Физическая химия с приложениями к биологическим системам. – М.: Мир, 1980.
8. Alberty R.A., Silbey R.J. Physical Chemistry. Second edition. – Wiley, 1997.
9. Atkins P.W. Physical Chemistry. Fifth edition. – Oxford University Press, 1994.
Не нашли, что искали? Воспользуйтесь поиском: