
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Основные законы и формулы. 1.Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона)
1.Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона) 


где P - давление газа, V - его объем, T -термодинамическаятемпература, m - масса газа, m - масса одного моля газа,
 -универсальная газовая постоянная,
-универсальная газовая постоянная,
 - число молей.
- число молей.
2. Количество вещества (в молях)
 или
или  ,
,
где N - число молекул газа, NA = 6,02.1023 моль -1 - постоянная Авогадро.
3. Количество вещества в смеси газов определяется по формуле:
n = n1+n2+...+nn = N1/NA + N2/NA +... + Nn/NA
или
n = m1/m1 + m2/m2 +... + mn/mn,
где nI, Ni, mi, mI - соответственно количество вещества, число молекул, масса, молярная масса i-й компоненты смеси.
Молярная масса смеси газов:
 ,
,
где mi - масса i-го компонента смеси, ni - количество вещества i-го компонента смеси, n - число компонентов смеси.
Массовая доля wi i-го компонента смеси газов (в долях единицы)
 ,
, 
где m- масса смеси.
Концентрация молекул


где N - число молекул, содержащихся в данной системе;
r -плотность веществ; V - объем системы.
Формула справедлива не только для газов, но и для любого агрегатного состояния вещества.
4. По закону Дальтона давление смеси газов равно сумме их парциальных давлений

где n - число компонентов смеси.
Парциальным давлением называется давление газа, которое имел бы каждый газ, входящий в состав смеси, при условии, что при данной температуре он один заполнял бы весь объем.
5.Основное уравнение молекулярно-кинетической теории:

или
 ,
,
где  - давление газа;
- давление газа;
 - число молекул в единице объема;
- число молекул в единице объема;
 - постоянная Больцмана;
- постоянная Больцмана;
 - средняя кинетическая энергия поступательного движения одной молекулы;
- средняя кинетическая энергия поступательного движения одной молекулы;
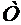 - абсолютная температура.
- абсолютная температура.
6.Средняя кинетическая энергия поступательного движения молекулы:
 ,
,
где 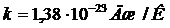 - постоянная Больцмана.
- постоянная Больцмана.
Средняя полная кинетическая энергия молекулы:
 ,
,
где i – число степеней свободы молекулы (для одноатомного газа i = 3;
для двухатомного газа i = 5; для многоатомного газа i = 6).
Средняя кинетическая энергия, приходящаяся на одну степень свободы:

Средняя кинетическая энергия поступательного движения молекул
 ,
,
где  - постоянная Больцмана;
- постоянная Больцмана;
7. Скорости молекул:
средняя квадратичная скорость
 ,
,
средняя арифметическая скорость
 ,
,
наиболее вероятная скорость
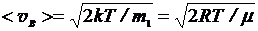 ,
,
где mi - масса одной молекулы.
8. Закон для распределения молекул идеального газа по скоростям (закон Максвелла):
 ,
,
где  - функция распределения молекул по скоростям.
- функция распределения молекул по скоростям.
9. Распределение Больцмана (распределение частиц в силовом поле)
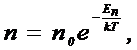
где n - концентрация частиц, En - потенциальная энергия молекулы в поле тяготения, n0 - концентрация частиц в тех точках поля, где E n = 0.
10. Барометрическая формула, выражающая зависимость давления идеального газа от высоты h над поверхностью Земли

где  - давление газа на высоте
- давление газа на высоте  ;
;
 - давление газа на высоте
- давление газа на высоте  ;
;
Т - термодинамическая температура воздуха на высоте  .
.
11.Средняя длина < l > свободного пробега молекул газа
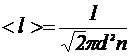 ,
,
где d - эффективный диаметр молекул; n – концентрация молекул газа.
12.Среднее число соударений молекул в единицу времени

13.Динамическая вязкость (коэффициент внутреннего трения):
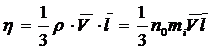 ,
,
где  - плотность газа (жидкости);
- плотность газа (жидкости);
 - концентрация молекул газа;
- концентрация молекул газа;
 - масса одной молекулы;
- масса одной молекулы;
 - средняя длина свободного пробега молекул.
- средняя длина свободного пробега молекул.
14. Теплопроводность (коэффициент теплопроводности) газа:
 ,
,
где 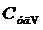 - удельная теплоемкость газа при постоянном объеме;
- удельная теплоемкость газа при постоянном объеме;
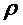 - плотность газа;
- плотность газа;
 - средняя арифметическая скорость молекул;
- средняя арифметическая скорость молекул;
 средняя длина свободного пробега молекул
средняя длина свободного пробега молекул
15. Диффузия (коэффициент диффузии):
 .
.
Не нашли, что искали? Воспользуйтесь поиском: