
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Основные законы и формулы. 1. Количество теплоты, сообщенное телу при теплообмене:
1. Количество теплоты, сообщенное телу при теплообмене:
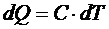 ,
,
где С – теплоемкость тела; Т – термодинамическая температура.
2. Виды теплоемкостей тел и связь между ними:
 ,
,
где 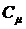 - молярная теплоемкость тела;
- молярная теплоемкость тела;  - удельная теплоемкость тела.
- удельная теплоемкость тела.
3. Молярные теплоемкости при разны процессах:
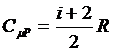 ;
;  ,
,
где  - молярная теплоемкость при изобарическом процессе;
- молярная теплоемкость при изобарическом процессе;
 - молярная теплоемкость при изохорическом процессе.
- молярная теплоемкость при изохорическом процессе.
4. Уравнение Роберта-Майера:
 .
.
5. Внутренняя энергия идеального газа:
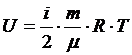 ,
,
где m - масса газа;  - молярная масса газа;
- молярная масса газа;
 - число степеней свободы молекулы;
- число степеней свободы молекулы;
 - молярная газовая постоянная;
- молярная газовая постоянная;
Т – термодинамическая температура.
или
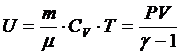
6. Элементарная работа, связанная с изменением объема газа:
 или
или  ,
,
где  и
и  - начальный и конечный объемы газа.
- начальный и конечный объемы газа.
7. Первое начало (закон) термодинамики
a) в дифференциальной форме:
 ,
,
где  - количество тепла, сообщенное системе;
- количество тепла, сообщенное системе;
 - изменение внутренней энергии системы;
- изменение внутренней энергии системы;
 - работа, совершенная системой.
- работа, совершенная системой.
б) в интегральной форме:
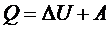 .
.
8. Работа газа при изотермическом процессе
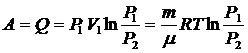 ,
,
где  и
и  - начальное и конечное давления.
- начальное и конечное давления.
9. Уравнение адиабатического процесса (уравнение Пуассона):
 или
или  ,
,
где 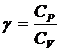 - показатель адиабаты.
- показатель адиабаты.
10. Термический коэффициент полезного действия тепловой машины:
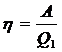 ,
,
где  - количество тепла, полученное системой от нагревателя;
- количество тепла, полученное системой от нагревателя;
A – работа цикла.
11. Термический коэффициент цикла Карно:
 ,
,
где  - тепло, полученное от нагревателя;
- тепло, полученное от нагревателя;
 - тепло, переданное холодильнику;
- тепло, переданное холодильнику;
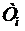 - температура нагревателя;
- температура нагревателя;  - температура холодильника
- температура холодильника
12. Изменение энтропии двух состояний системы:
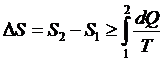 ,
,
где 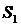 и
и  - начальное и конечное состояние системы. Знак равенства соответствует обратимом процессу, а знак неравенства – необратимому.
- начальное и конечное состояние системы. Знак равенства соответствует обратимом процессу, а знак неравенства – необратимому.
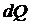 - элементарное количество теплоты, полученное телом при температуре Т.
- элементарное количество теплоты, полученное телом при температуре Т.
 ,
,
т.е изменение энтропии идеального газа при переходе его из состояния 1 в состояние 2 не зависит от вида процесса перехода.
При адиабатическом процессе:
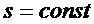 ;
;  .
.
При изотермическом процессе:
 .
.
При изохорном процессе:
 .
.
13. Энтропия для квазистационарных процессов:
 .
.
14. Формула Больцмана:
 ,
,
где 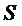 - энтропия системы;
- энтропия системы;
 - термодинамическая вероятность состояния системы;
- термодинамическая вероятность состояния системы;
 - постоянная Больцмана.
- постоянная Больцмана.
Не нашли, что искали? Воспользуйтесь поиском: