
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Примеры решения задач на тему. «Молекулярно-кинетическая теория идеального газа»
«Молекулярно-кинетическая теория идеального газа»
Задача 1. Баллон содержит 80 г кислорода и 300 г аргона. Давление смеси 10 атм, температура 150С. Принимая данные газы за идеальные, определить емкость баллона.
Дано: m1 = 80 г = 8.10-2кг;
Аr m2 = 300 г = 3.10-1кг;
t = 150C; Т = 288К.
P = 10 атм = 1,01.106 Па.
_____________________
V -?
Решение.
По закону Дальтона давление смеси равно сумме парциальных давлений газов, входящих в состав смеси. Парциальным давлением газа называется давление, которое производил бы газ, если бы только он один находился в сосуде, занятом смесью.
По уравнению Менделеева-Клапейрона парциальные давления кислорода P1 и аргона P2 выражаются формулами
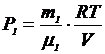 и
и 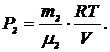 (1)
(1)
По закону Дальтона для смеси газов
P = P1 + P2, (2)
или
 (3)
(3)
где  - молярная газовая постоянная
- молярная газовая постоянная
Из (3) выражаем объем баллона:
 (4)
(4)
Проверим размерность расчетной формулы:
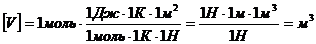 .
.
Подставим числовые значения в формулу (4) и произведем вычисления:

Ответ: объем баллона равен 24 л.
Задача 2. Найти кинетическую энергию вращательного движения одной молекулы кислорода при температуре 130С, а также кинетическую энергию вращательного движения всех молекул, содержащихся в 4 г кислорода.
Дано:
 ;
;



_____________
eвр -? Wвр -?
Решение.
Известно, что на каждую степень свободы молекулы газа приходится одинаковая энергия, выражаемая формулой
 (1)
(1)
где k - постоянная Больцмана, T - абсолютная температура газа.
Так как вращательному движению двухатомной молекулы (молекула кислорода - двухатомная) приписываются две степени свободы, то энергия вращательного движения молекулы кислорода выразится формулой
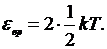 (2)
(2)
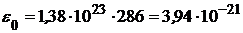 (Дж).
(Дж).
Кинетическая энергия вращательного движения всех молекул газа:
 , (3)
, (3)
где N - число всех молекул газа.
Число молекул N можно получить по формуле
 (4)
(4)
где NA - число Авогадро, n - количество вещества в молях:
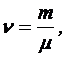
где m - масса газа, m - масса одного моля газа, следовательно,
 (5)
(5)
Подставив это выражение N в формулу (3), получим
 (6)
(6)
Подставим численные значения физических величин в формулу (6) и произведем вычисления, получим:

Ответ: кинетическая энергия вращательного движения одной молекулы кислорода при температуре 130С равна  Дж, кинетическая энергия вращательного движения всех молекул равна 296 Дж.
Дж, кинетическая энергия вращательного движения всех молекул равна 296 Дж.
Задача 3. В современной вакуумной камере достигается вакуум порядка 0,1 нПа. Какова средняя длина свободного пробега молекул азота в камере при температуре  . Чему равно среднее число столкновений каждой молекулы с остальными в единицу времени?
. Чему равно среднее число столкновений каждой молекулы с остальными в единицу времени?
(Массу молекулы азота считать равной 5.10-20 кг).
Дано:
N2
P =0,1 нПа=10-10Па;
 ; Т =300К;
; Т =300К;
m1 = 5.10-20 кг.
_________________
 -? <z> -?
-? <z> -?
Решение.
Средняя длина свободного пробега молекул определяется из соотношения:
 , (1)
, (1)
где < v > - средняя арифметическая скорость молекул,
< z > - среднее число столкновений каждой молекулы с остальными в единицу времени,
n - концентрация молекул газа, 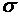 - эффективный диаметр молекулы.
- эффективный диаметр молекулы.
Концентрация молекул газа связана с его давлением соотношением:
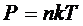 , (2)
, (2)
где к – постоянная Больцмана, Т – термодинамическая температура.
Таким образом,
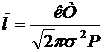 . (3)
. (3)
Эффективный диаметр молекулы 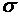 =3 10-10м,
=3 10-10м,
Постоянная Больцмана к =1,38 10-23 Дж/К,
Произведем вычисления по формуле (3):
 .
.
Из формулы (1) выразим среднее число столкновений <z> молекул в единицу времени:
 , (4)
, (4)
где средняя арифметическая скорость молекул
 . (5)
. (5)
Подставим выражение (5) в формулу (4), получим::
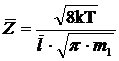 ,
,
где  - постоянная Больцмана; Т- термодинамическая температура;
- постоянная Больцмана; Т- термодинамическая температура;
 - средняя длина свободного пробега молекул;
- средняя длина свободного пробега молекул; 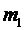 - масса одной молекулы.
- масса одной молекулы.
Произведем вычисления:
 .
.
Ответ: средняя длина свободного пробега молекул равна  ; среднее число столкновений, испытуемых одной молекулой в единицу времени, равно
; среднее число столкновений, испытуемых одной молекулой в единицу времени, равно  .
.
Задача 4. Азот находится по давлением  при температуре 290 К. Определите коэффициент диффузии D и внутреннего трения
при температуре 290 К. Определите коэффициент диффузии D и внутреннего трения  . Эффективный диаметр молекул азота принять равным
. Эффективный диаметр молекул азота принять равным  .
.
Дано:  ;
;
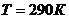 ;
;

__________________________


Решение.
На основании представлений молекулярно-кинетической теории газов коэффициент внутреннего трения идеального газа (динамическая вязкость) и коэффициент диффузии определяются по формулам:
 , (1)
, (1)
 ; (2)
; (2)
 (3)
(3)
где  - средняя длина свободного пробега молекул азота;
- средняя длина свободного пробега молекул азота;
 - коэффициент внутреннего трения;
- коэффициент внутреннего трения;
 - коэффициент диффузии;
- коэффициент диффузии;
n - концентрация молекул газа;
 - средняя скорость молекул газа;
- средняя скорость молекул газа;
 - масса одной молекулы;
- масса одной молекулы;
 эффективный диаметр молекул газа.
эффективный диаметр молекул газа.
Концентрацию молекул газа по заданным значениям давления и температуры определим из основного уравнения молекулярно-кинетической теории газов:
 . (4)
. (4)
Выражая концентрацию из уравнения (4) и подставляя в формулу (1) получим

Проверка размерности расчетной формулы:
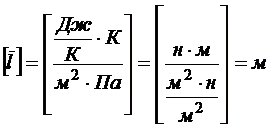
Средняя скорость молекул
 , (5)
, (5)
где  – молярная газовая постоянная;
– молярная газовая постоянная;
Т – термодинамическая температура;
 - молярная масса азота.
- молярная масса азота.
Вычислим среднюю скорость молекул азота:
 .
.
Проверка размерности расчетной формулы:
 ;
;
Для расчета коэффициента диффузии воспользуемся полученными результатами:
 .
.
Для расчета коэффициента внутреннего трения подставим в формулу (3) концентрацию n и массу одной молекулы азота  , учитывая, что
, учитывая, что
 ;
;
 ;
;
Имеем:
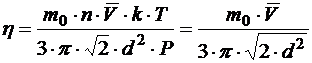 ;
;
Масса одной молекулы газа
 ,
,
где  - молярная масса газа,
- молярная масса газа,  постоянная Авогадро.
постоянная Авогадро.
Произведем вычисления:
 ;
;
 .
.
Проверка размерности расчетной формулы:

Ответ: коэффициент диффузии равен  ,
,
коэффициент внутреннего трения равен  .
.
Задача N 5. Каково давление воздуха в шахте на глубине 1 км, если считать, что температура по всей высоте постоянна и равна 22  С, а ускорение свободного падения не зависит от высоты. Давление воздуха у поверхности Земли принять равным
С, а ускорение свободного падения не зависит от высоты. Давление воздуха у поверхности Земли принять равным  .
. 

Дано:

Решение.
Воспользуемся барометрической формулой:
 , (1)
, (1)
где  и
и  - давления воздуха на высоте
- давления воздуха на высоте  и
и  соответственно;
соответственно;
 - молярная масса воздуха;
- молярная масса воздуха;
 - ускорение свободного падения;
- ускорение свободного падения;
 - молярная газовая постоянная;
- молярная газовая постоянная;
 - термодинамическая температура.
- термодинамическая температура.
За начало отсчета высоты примем дно шахты, тогда  ;
;
 112291,9
112291,9  .
.

Ответ: давление воздуха на дне шахты  .
.
Основы термодинамики
Не нашли, что искали? Воспользуйтесь поиском: