
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
ЗАВИСИМОСТЬ ФИЗИКО-ХИМИЧЕСКИХ СВОЙСТВ И ФАРМАКОЛОГИЧЕСКОГО ДЕЙСТВИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ ОТ СТРОЕНИЯ МОЛЕКУЛЫ
Лекарственные вещества органической природы проявляют активность в зависимости от:
- растворимости, определяемой кислотно-основными свойствами в полярных и неполярных растворителях;
- окислительно-восстановительного потенциала, позволяющего оценить реакционную способность (устойчивость)молекулы ЛВ с окислителями и восстановителями в отдельных камерах биологических систем.
Кислотно-основные свойства могут быть оценены по значениям константы кислотной (основной) ионизации (закон действующих масс) и степени гидроили липофильности (константа распределения Нернста). Например, известно, что бензол (рКа = 43) практически нерастворим в воде, но растворим в липидах. При введении в молекулу бензола карбоксильной группы растворимость образующейся бензойной кислоты (рКа = 4,7) в воде значительно возрастает. И как следствие увеличивается способность участвовать в химических превращениях в полярных средах организма.
Окислительно-восстановительные свойства оценивают по значению стандартного окислительно-восстановительного потенциала Е° (или связанной с ним энергией Гиббса ΔG°). Соответствие этих характеристик аналогичным факторам жидких биосред может быть охарактеризовано на основании «Е-рН» (или «AG-рН») диаграмм крови, лимфы, цитоплазмы и других биосистем. Если области устойчивости (существования) ЛВ и биологической среды совпадают (Е, рН), то можно предполагать проявление биологической (терапевтической) активности вещества.
Следующий этап оценки биологической активности заключается в рассмотрении пространственного соответствия при лигандрецепторном (L-R) взаимодействии: L + R → L - R, где лиганд L - молекула ЛВ, рецептор R - активный центр биомолекулы в организме, с которым взаимодействует молекула ЛВ.
Примеры, представленные ниже, демонстрируют, как структура молекулы органического вещества влияет на его биологическую активность. Так, ненасыщенные соединения обычно значительно активнее насыщенных. Это относится в одинаковой мере к ациклическим и циклическим соединениям. Например, снотворные свойства трихлорэтилена более выражены, чем таковые у 1,1,2-трихлорэтана:

Терапевтическое действие ЛС может изменяться с введением заместителей.
Значительное влияние на физиологическую активность ЛВ оказывает введение в его молекулу атомов галогенов. Например, метан не проявляет наркотического действия. Напротив, хлорпроизводные: метилхлорид CH3Cl, хлороформ CHCl3, этилхлорид CH3CH2Cl - обладают наркотическими свойствами. Хлораль CCl3CHO обладает более сильным гипнотическим действием, чем уксусный альдегид CH3CHO:

Введение в молекулу углеводорода гидроксильной группы также приводит к усилению биологической активности ЛВ.
С увеличением числа гидроксильных групп наркотическое действие алифатических спиртов снижается. Например, глицерин (пропан-1,2,3-триол), в отличие от этанола, наркотическими свойствами не обладает. Это объясняется большей растворимостью полигидроксильных соединений в воде и уменьшением их растворимости в липидах, поэтому многоатомные спирты не способны проникать в богатые липидами нервные клетки и не оказывают наркотического действия.
Введение гидроксильной группы в бензольное кольцо приводит к появлению антисептических свойств, которые, например, у двухатомного фенола резорцина выражены значительно больше, чем у одноатомного фенола.
Антисептическое действие фенолов усиливается введением в ядро атомов брома. Так, у трибромфенола эти свойства сильнее, чем у фенола или резорцина:

Введенная в молекулу ароматического соединения карбоксильная группа -СООН снижает токсичность за счет увеличения гидрофильности. К примеру, натриевая соль салициловой кислоты менее токсична, чем фенол:

Функциональные группы, содержащие азот, усиливают действие веществ на различные отделы нервной системы. Присутствие в молекуле аминогруппы резко повышает токсичность ЛВ. Вторичные амины, как правило, более активны, чем третичные, но менее активны, чем первичные.
Сложные эфиры азотной кислоты (например, нитроглицерин) подвергаются превращениям, в результате которых образуется NO, оксид азота (II), который оказывает сосудорасширяющее действие.
Значительно меньше изучен вопрос о направленности и силе действия при комбинации двух заместителей и более в одной молекуле органического соединения. На примере ряда гетероциклических соединений установлено, что фармакологический эффект зависит от ориентации различных заместителей.
Большое значение имеет изучение связи между фармакологической активностью и изомерией молекул органических соединений. Например, двухатомные фенолы отличаются по своей токсичности. Наименее токсичен метаизомер резорцин (м-дигидроксибензол).
Биологическое действие зависит также от цис-транс -изомерии и трео-эритро -изомерии. Нередко наблюдают одновременное влияние различных типов изомерии на фармакологический эффект. Так, антибиотик хлорамфеникол (левомицетин):
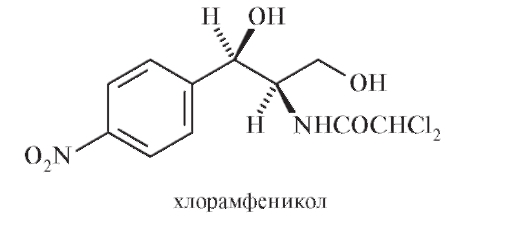
представляет собой D-(-)-трео-1-n-нитрофенил-2-дихлорацетиламинопропандиол-1,3. Его эритро-формы являются токсичными веществами, а L-(-)-трео-изомер (правовращающий антипод левомицетина) физиологически неактивен.
Природа органических соединений обусловливает особенности их анализа.
Прокаливание. ЛВ органической природы при прокаливании обычно плавятся, обугливаются, сгорают без остатка. ЛВ неорганической природы, напротив, не горят, не обугливаются, хотя при прокаливании можно наблюдать некоторые изменения: кристаллические вещества плавятся; расплав может кипеть, выделяя пары воды (кристаллогидраты и некоторые гигроскопичные вещества). Неорганическое вещество может при нагревании менять окраску. Например, ZnO и BiONO3 желтеют при прокаливании. Напротив, оксиды щелочноземельных металлов и их сульфаты окраску не изменяют.
ЛВ смешанной природы - к примеру, соли органических кислот и щелочных или щелочноземельных металлов (натрия бензоат, кальция глюконат, аскорбат железа) - обугливаются, и их органическая часть сгорает.
Определение рН водного раствора. Большинство ЛВ органической природы - неэлектролиты, которые малорастворимы в воде. Исключение составляют соли органических кислот и оснований (например, кальция глюконат, натрия бензоат, натрия салицилат, соли различных азотсодержащих соединений), растворы которых в воде имеют то или иное значение рН.
Определение природы функциональных групп. Большинство ЛВ являются полифункциональными соединениями (реакции на различные функциональные группы приведены в ГФ в разделе «0бщие реакции на подлинность»).
Например, в молекуле прокаина (новокаина) одновременно присутствуют аминогруппы, сложноэфирная группа, ароматическое кольцо.
Определение природы гетероатома. Многие органические соединения содержат гетероатомы - серу, азот, фосфор или галогены. При анализе эти элементы переводят в ионную форму и затем устанавливают природу гетероатома. В зависимости от строения ЛВ прочность связи углерода с галогеном или другим гетероатомом различна. Так, при нагревании в присутствии концентрированной серной кислоты разрыв связи облегчается в ряду «C-F, C-Cl, C-Br, C-I» в связи с уменьшением ее прочности.
Природу гетероатома выясняют посредством следующих качественных реакций:
- хлоропроизводные органические соединения дают положительную пробу Бельштейна - вещество на медной проволоке помещают в пламя горелки, пламя окрашивается в зеленый цвет;
- при нагревании некоторые органические соединения йода (например, йодоформ) выделяют фиолетовые пары йода;
- при нагревании спиртового раствора некоторых соединений йода с раствором нитрата серебра AgNO3образуется желтый осадок серебра йодида

- галогенопроизводные углеводородов (например, хлороформ, левомицетин) нагревают со щелочью и после гидролиза определяют галогенид-ион в водном растворе. Для переведения ковалентно связанного галогена в ионную форму используют различные методы минерализации:
■ окислительные методы - сжигание в колбе с кислородом; «сухая» минерализация в щелочном окислительном расплаве - смеси натрия карбоната и калия нитрата; «влажная» минерализация в концентрированных серной и азотной кислотах (или других кислотах-окислителях), в растворах пероксида водорода и калия перманганата; более эффективна минерализация при нагревании в тефлоновых реакторах, помещенных в автоклавы или печь СВЧ;
■ восстановительные методы - перевод в ионную форму под действием цинка в кислой или щелочной среде (восстановитель - выделяющийся атомарный водород).
Определение относительной молекулярной массы. Для установления истинной брутто-формулы исследуемого вещества необходимо определить относительную молекулярную массу. В зависимости от свойств вещества, для ее установления используют такие физические методы, как эбулиоскопический, криоскопический, изотермической дистилляции, газометрический.
Определение физико-химических характеристик. Для предварительного заключения о природе ЛВ выполняют определение температуры плавления. Для характеристики природы и чистоты жидких лекарственных средств определяют плотность, показатель преломления (рефрактометрия) и удельное вращение (поляриметрия). Для идентификации масел и жиров характерны такие химические характеристики, как кислотное число, число омыления, йодное число.
Общие испытания ЛВ с помощью реакций образования красителей. Для испытаний подлинности ЛС в зависимости от природы функциональных групп в молекулах ЛВ используют общие реакции. Например, возможно проведение анализа ЛВ органической природы с помощью реакций образования красителей.
Для того чтобы соединение было окрашенным, энергия возбуждения его молекулы ΔЕ= Е' - Ео (где Ео и Е - энергия молекулы в основном и возбужденном состоянии соответственно) должна находиться в пределах 158-300 кДж/моль. Для соединений с сопряженными двойными связями, у которых π-электроны делокализованы, энергия возбуждения соответствует поглощению в видимой части спектра.
Цвет образующегося продукта обусловлен присутствием в его молекуле хромофорной системы - достаточно развитой открытой или замкнутой системы сопряженных кратных связей и электронодонорных и/или электроноакцепторных заместителей. В соответствии с типом хромофора (группы, ответственной за создание сопряженной системы), все используемые в химико-фармацевтическом анализе красители можно классифицировать следующим образом: - арилметановые или ауриновые красители - производные диарил- и триарилметанов:

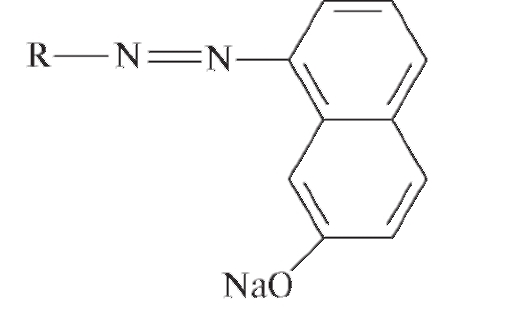
- азокрасители (содержат азогруппу -N=N-):
- азометиновые красители (содержат одну или несколько азометиновых групп -C=N-, входящих в систему сопряженных двойных связей):

- индофенольные красители, образующиеся при взаимодействии хинонимина с фенолами, например, с нафтолом:
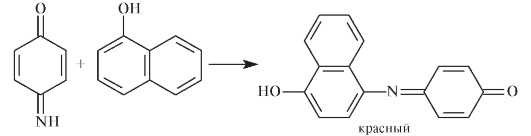
Образование красителей может быть использовано для определения подлинности субстанции. Так, для идентификации ароматических аминов и фенолов используется реакция образования азокрасителя по реакции азосочетания с солями диазония.
Соли арилдиазония могут быть получены при взаимодействии первичных ароматических аминов с азотистой кислотой (реакция диазотирования). Электрофильной частицей, атакующей ароматический амин, выступает нитрозил-катион:

Соли арилдиазония бесцветны или окрашены в светло-желтый цвет, неустойчивы, хорошо растворимы в воде; их получают в водных растворах и сразу же используют для дальнейших превращений:

Указанный интервал значений рН оптимален: ароматический фенол (нафтол) превращается в феноксид-ион, который проявляет +М-эффект и активирует ароматическое кольцо к электрофильной атаке. При более низкой щелочности раствора концентрация ионизированных молекул ароматического фенола (нафтола) будет небольшой, что приведет к снижению скорости реакции. При более высоких значениях рН соль диазония превращается в диазогидроксид, не проявляющий свойств электрофильной частицы, а следовательно, не вступающий в реакцию азосочетания.
Сочетание соли диазония с фенолами или третичными аминами протекает в пара-положении к гидроксильной или аминогруппе. Если пара-положение занято, то азосочетание происходит в орто положении. Это связано с ориентирующим влиянием аминои гидроксигрупп (ориентанты первого рода) в фенолах и аминах. ЛВ, содержащие первичную аминогруппу, могут играть роль диазокомпонентов после реакции с азотистой кислотой.
Ароматические амины, содержащие электроноакцепторные заместители (заместители второго рода -NO2, -SO3H, -CHO, -COOH), особенно в орто- или пара-положении, диазотируются легче, чем незамещенные, и дают более прочные соли диазония. Таким образом, прочность соли диазония увеличивается с ростом электроноакцепторных свойств ароматического ядра и ослаблением прочности связи между азотом и водородом в аминогруппе. Этому способствует также понижение температуры. Напротив, в случае электронодонорных заместителей (заместителей первого рода) или алифатического радикала прочность диазосоединения снижается.
Реакция образования азометиновых красителей протекает при взаимодействии ароматического альдегида с ароматическим амином, диамином или гидразином при нагревании в водной среде.
Например, реакция взаимодействия изониазида с ароматическим альдегидом - ванилином приводит к получению фтивазида. Фтивазид - светло-желтый или желтый мелкокристаллический порошок со слабым запахом ванилина, без вкуса, окраска которого обусловлена присутствием в структуре азометиновой группы:

Образование арилметановых (ауриновых) красителей используют при идентификации различных ЛВ. Красители этой группы образуются при конденсации ароматических альдегидов или формальдегида с ароматическими аминами и фенолами, например хинолином:

В результате образуется соединение, окраска которого обусловлена существованием ионных мезомерных форм, содержащих хромогенные цепи. Окраска ауринового красителя, в зависимости от природы субстрата, может варьировать от розовой до красно-фиолетовой.
Некоторые авторы механизм образования арилметанового красителя представляют иным образом:

Получение индофеноловых красителей лежит в основе определения фенолов и пара-аминофенолов. Например, при взаимодействии пиридоксина, содержащего фенольный гидроксил, с 2, 6-дихлорхинонхлоримином образуется индофенольный краситель синего цвета:

который обратимо меняет окраску при изменении рН среды.
Не нашли, что искали? Воспользуйтесь поиском: