
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Лекарственное средство этанол - представитель класса спиртов
| Лекарственное средство | Фармакологическая группа | Физико-химические свойства |
| Спирт этиловый Этанол 95% Spiritus aethylicus C2H5OH C2H6O Mr 46,1 | Органический растворитель для получения настоек, экстрактов, а также в виде 50-70% раствора для наружного применения в качестве дезинфицирующего средства и раздражающего средства в виде обтираний и компрессов | Прозрачная летучая (Ткип 78,3 °С) бесцветная подвижная жидкость, легко воспламеняется, имеет характерный запах, жгучий вкус; горит синим пламенем, смешивается в любых соотношениях с водой, эфиром, хлороформом, ацетоном и глицерином. Более высокая температура кипения по сравнению с изомером - диэтиловым эфиром - обусловлена водородными связями. Смесь спирта с воздухом (3-19%) взрывоопасна |
В зависимости от числа гидроксильных групп спирты бывают одно- или многоатомные:

В зависимости от того, при каком атоме углерода (первичном, вторичном или третичном) находятся гидроксильные группы, различают первичные, вторичные и третичные спирты:

Введение гидроксильной группы в молекулу углеводорода повышает его растворимость в воде. Действительно, спирты, особенно низшие, хорошо растворяются в воде. С увеличением длины углеродной цепи растворимость спиртов уменьшается. Как правило, вторичные спирты более растворимы, чем первичные, а третичные - более растворимы, чем вторичные. Закономерно изменяется и температура кипения спиртов: она возрастает от первичных спиртов к третичным. Спирты, содержащие менее 12 атомов углерода, представляют собой жидкости. Температура кипения многоатомных спиртов выше за счет увеличения числа межмолекулярных водородных связей.
Химические свойства спиртов определяются их функциональной группой - гидроксильной группой -ОН. Спирты являются слабыми ОН-кислотами, поэтому щелочные металлы вытесняют из спиртов водород:

Образующиеся алкоголяты легко гидролизуются:
R-ONa + H2O → ROH + NaOH
С увеличением числа ОН-групп кислотные свойства спиртов возрастают, что связано с высокой электроотрицательностью кислорода и ослаблением О-Н-связи соседнего гидроксила.
Спирты при нагревании в присутствии концентрированной серной кислоты могут вступать в реакцию внутримолекулярной дегидратации:
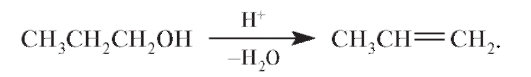
В более мягких условиях (температура 170 °С, каталитические

При взаимодействии спиртов с карбоновыми кислотами (в присутствии следов сильных минеральных кислот) образуются сложные эфиры.

Реакция образования сложных эфиров называется этерификацией. Вода в присутствии кислот или щелочей разлагает сложные эфиры с образованием исходных веществ - кислоты и спирта.
Первичные и вторичные спирты легко окисляются, причем при окислении первичных спиртов образуются альдегиды, которые окисляются в карбоновые кислоты:

Вторичные спирты окисляются до кетонов:

Для окисления применяют соединения марганца(IV), марганца(VII), хрома(VI).
Третичные спирты окисляются с большим трудом.
Низшие спирты не поглощают в УФ-области спектра и используются в спектрофотометрии как растворители.
Спиртами алхимики называли летучие вещества (от лат. spiritus - дух), выделяющиеся при получении вина.
Получение
Синтетический этиловый спирт получают гидратацией этилена в присутствии фосфорной (или серной) кислоты:
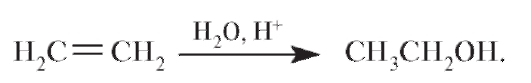
Значительное количество этилового спирта, так называемый гидролизный спирт, получают из отходов лесной промышленности.
При получении спирта брожением пищевого сырья, содержащего крахмал зерновых культур, картофеля, к нему добавляют солод - измельченные проросшие зерна ячменя. Содержащийся в солоде фермент амилаза катализирует превращение крахмала в мальтозу:

Затем под влиянием фермента мальтазы дрожжей дисахарид мальтоза превращается в глюкозу:

Глюкоза под влиянием зимазы дрожжей дает конечные продукты брожения - спирт и углекислый газ:

Для брожения наиболее благоприятна температура 25-30 °С.
Образующийся спирт содержит сивушные масла - побочные продукты, образующиеся в процессе брожения: уксусный альдегид, смесь высших спиртов и карбоновых кислот и некоторых других веществ.
Спирт, предназначенный для медицинских целей, очищают от токсичных сивушных масел фильтрованием через активированный уголь. После этого спирт подвергают дробной перегонке (ректификации).
Промышленный спирт-ректификат содержит 95-96% этанола. Удалить дробной перегонкой оставшиеся 4-5% воды из спирта не удается, так как этиловый спирт, имеющий температуру кипения Ткип 78,3 °С, образует с водой азеотропную смесь, кипящую при температуре 78,15 °С.
Чтобы получить абсолютный спирт, азеотропную смесь освобождают от воды химическим способом. Впервые абсолютный спирт был получен нагреванием спирта со свежепрокаленной негашеной известью СаО:
2СаО + 2Н2О → Са(ОН)2.
Абсолютировать спирт можно с помощью безводного хлорида кальция или сульфата меди. Для этого в склянку с притертой пробкой помещают прокаленную, т.е. обезвоженную, соль, например сульфат меди, затем приливают 95% спирт (из расчета 1 л спирта на 500 г прокаленной соли) и оставляют смесь на 2 сут, время от времени перемешивая ее. Постепенно кристаллы сульфата меди приобретают синюю окраску, что связано с образованием кристаллогидрата:

Затем спирт отгоняют в приемник, снабженный трубкой с натронной известью (смесь едкого натра NaOH и гашеной извести Ca(OH)2, поглощающая воду и CO2 воздуха).
В настоящее время применяют метод абсолютирования спирта с помощью этилата алюминия, который поглощает воду с образованием гидроксида алюминия:

Можно также освободить спирт от воды, добавляя к водному спирту бензол и подвергая смесь перегонке. В этом случае сначала отгоняется постоянно кипящая тройная азеотропная смесь «бензол-вода-спирт» (Ткип 64,85 °С), затем бинарная азеотропная смесь «спирт-бензол» (Ткип 67,8 °С) и, наконец, чистый безводный спирт (78,3 °С).
Концентрация спирта выражается в массовых или объемных долях в процентах (1 объемный % = 1°). В фармацевтической практике концентрацию спирта выражают обычно в объемных процентах (градусах).
Имеются следующие продажные сорта спирта: 1) спирт-сырец 93-95% крепости; этот спирт недостаточно очищен от сивушных масел и альдегидов; 2) ректифицированный спирт 95-96%, очищенный и почти без примесей; 3) абсолютный спирт 100%, безводный; 4) денатурированный спирт-сырец, к которому добавлены пиридиновые основания, метиловый спирт или сивушные масла. Последний очень ядовит и имеет неприятный запах. Чтобы отличить денатурированный спирт от винного, его подкрашивают. Применяется денатурированный спирт только для хозяйственных целей, например для работы спиртовки.
ГФ описывает следующие препараты спирта: безводный, т.е. абсолютный, спирт, и спирт этиловый 95, 90, 70 и 40%. ЕФ содержит 2 статьи: «Этанол (96%)» и «Этанол безводный».
Не нашли, что искали? Воспользуйтесь поиском: