
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Механизмы действия и биотрансформация. Снотворное действие барбитуратов связано с их способностью вызывать иррадиацию процесса торможения в коре головного мозга
Снотворное действие барбитуратов связано с их способностью вызывать иррадиацию процесса торможения в коре головного мозга. Избирательно угнетают моторную зону головного мозга, что обусловливает их противосудорожное действие.
В средних терапевтических дозах барбитураты способны понижать тонус кишечной мускулатуры, что приводит к ослаблению перистальтики. Легко проходят через плацентарный барьер.
Продолжительно (медленно) действующие барбитураты выводятся преимущественно почками; непродолжительно (быстро) действующие - в значительной степени разрушаются в печени.
Особенностью барбитуратов является их способность вызывать индукцию микросомальных ферментов печени, следовательно, при повторном введении ЛС скорость их метаболизма возрастает. Это, в свою очередь, приводит к привыканию - толерантности к барбитуратам.
Основными путями биотрансформации барбитуратов является гидроксилирование и окислительное дезаминирование.
При гидроксилировании происходит окисление ксенобиотика в гидроксипроизводное под действием монооксигеназы CYP-450:
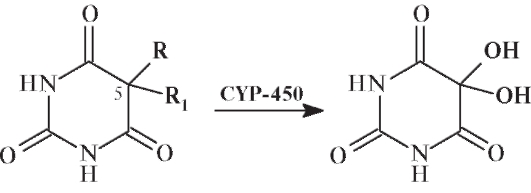
Гидроксилированные метаболиты быстрее и полнее выводятся из организма.
При отравлении барбитуратами выделены синдромы:
- коматозные состояния и другие неврологические расстройства;
- нарушение внешнего дыхания;
- нарушения функций сердечно-сосудистой системы;
- трофические расстройства и нарушения функции почек. Алкоголь и антигистаминные препараты обладают синергетическим эффектом при одновременном приеме с барбитуратами.
Антидотная терапия (при неосложненной форме отравления) заключается в введении дыхательных аналептиков (бемегрид, кордиамин, эфедрин).
Контроль качества
Определение подлинности. Подлинность производных барбитуровой кислоты определяют по температуре плавления субстанций. Для этого смешивают эквивалентные количества субстанции и стандартного образца ЛВ и определяют температуру плавления смеси. Разница между точками плавления (около 190 °С для барбитала) не должна превышать 2 °С.
УФ-спектры барбитуратов имеют максимумы поглощения в области 220-280 нм.
ИК-спектры барбитуратов получают, применяя метод прессования в таблетках с калия бромидом в области 4000-400 см-1. Полученные спектры сравнивают со спектрами стандартных образцов.
При хроматографировании растворов барбитуратов в тонком слое сорбента в качестве неподвижной фазы используют силикагель. Роль подвижной фазы играет смесь из 25% раствора аммиака, 96% этилового спирта и хлороформа (5:15:80). Тестируемый раствор и раствор сравнения готовят растворением 75 мг вещества в 25 мл этилового спирта. Хроматограмму облучают УФ-светом при длине волны 254 нм: пятно на хроматограмме, соответствующее определяемому веществу, должно быть идентично по положению и размеру пятну стандартного вещества.
Подлинность барбитуратов устанавливают также с помощью химических реакций. С солями тяжелых металлов образуются осадки или растворимые координационные соединения. Например, при добавлении к раствору барбитала натрия эквимолярного количества раствора серебра нитрата образуется монозамещенная растворимая соль. При избытке реактива выпадает белый осадок двузамещенной соли:
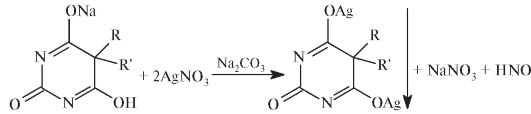
С солями Cu(II) и Fe(III) барбитураты образуют малорастворимые окрашенные координационные соединения. Эти реакции можно использовать для отличия отдельных барбитуратов. Например, в слабощелочном растворе (карбонатный буфер) барбитал с солью меди(П) образует синее окрашивание, а затем выпадает осадок красного цвета. Фенобарбитал осаждается в виде соли меди(П) с устойчивой сиреневой окраской.
При сплавлении барбитуратов со щелочами образуются продукты разложения: аммиак, карбонат натрия и натриевая соль соответствующей карбоновой кислоты. При последующем добавлении в реакционную смесь минеральной кислоты выделяется углекислый газ и ощущается запах карбоновой кислоты, вытесненной из соли:


Частные реакции идентификации основаны на структурных особенностях производных барбитуровой кислоты. Например, при определении фенобарбитала используют реакцию нитрования с последующим восстановлением нитрогруппы, затем диазотирование и азосочетание (за счет фенильного заместителя в положении С5) с образованием азокрасителя вишневого цвета:
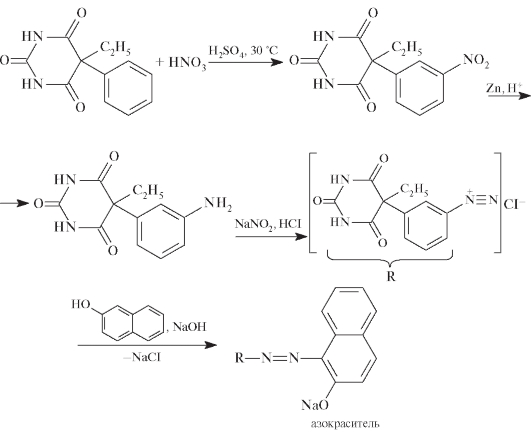
Подлинность бензобарбитала может быть установлена по реакции образования сине-фиолетового гидроксамата железа(Ш) (гидроксамовая реакция):

Испытания на чистоту. Испытания на чистоту барбитуратов проводят по следующим показателям.
• Потеря в массе при высушивании (летучие примеси и вода) - для фенобарбитала и барбитала - не более 0,5% из 1,0 г вещества.
• Определение остатка после сжигания (неорганические примеси) - не более 0,5% на 1,0 г вещества.
• Кислотность, цветность растворов.
• Родственные примеси. Определяют методом ТСХ.
Количественное определение. Количественное определение барбитуратов проводят спектральными и титриметрическими методами:
- спектрофотометрия в УФили видимой области (после предварительно проведенной хромогенной реакции);
- кислотно-основное титрование в среде протофильного растворителя (ДМФА, пиридин) при определении лактамных форм барбитуратов;
- кислотно-основное титрование в водно-спиртовой или водно-эфирной среде при определении лактимных форм барбитуратов-солей;
- аргентометрия.
Количественное аргентометрическое определение барбитала проводят по следующей методике: 85,0 мг субстанции растворяют в 5 мл пиридина, добавляют 0,5 мл раствора тимолфталеина и 10 мл раствора серебра нитрата, приготовленного на пиридине. Титруют 0,1 моль/л спиртовым раствором NaOH до появления синего окрашивания смеси.
Рассмотрим отдельные этапы количественного анализа.
• Растворитель-пиридин, проявляя свойства основания, присоединяет протоны, барбитал - отдает протоны, проявляя свойства кислоты. При этом образуются сопряженные кислота и основание (ионная пара):
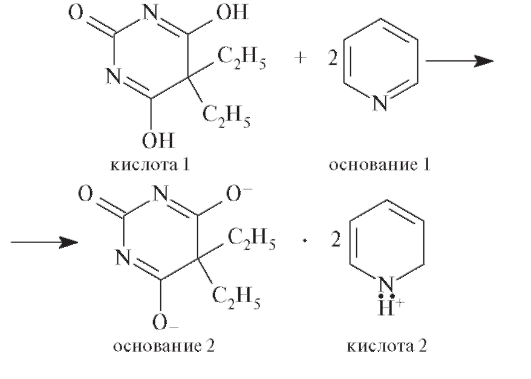
• Добавление к смеси раствора AgNO3 приводит к образованию дизамещенной серебряной соли барбитала, регенерации растворителя и выделению эквивалентного количества азотной кислоты (заместителя):
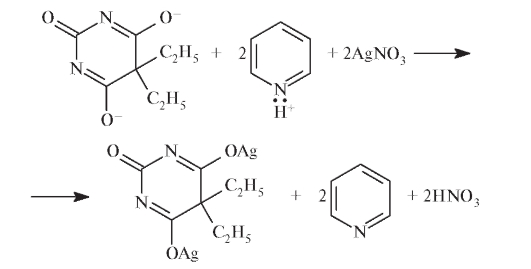
• На заключительном этапе азотную кислоту количественно оттитровывают раствором NaOH:
HNO3 + NaOH = NaNO3 + H2O
1 мл 0,1 моль/л спиртового раствора натрия гидроксида эквивалентен 9,21 мг барбитала.
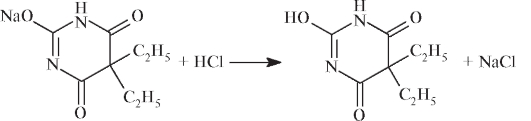
Водные растворы натриевых солей барбитуратов количественно определяют титрованием 0,1 моль/л раствором НС1 с индикатором метиловым оранжевым при добавлении органического растворителя для экстракции образующейся слабой кислоты (лактимная форма).
При титровании происходит вытеснение слабой кислоты из соли:
Контрольные вопросы и задания
• Напишите структурную формулу, дайте рациональное название; перечислите лекарственные формы препаратов тиамина. Охарактеризуйте биологическую роль тиамина в организме.
• Объясните основную природу тиамина, поясните, почему он образует двойные соли?
• Объясните причину нестабильности тиамина в щелочной среде. Напишите химические реакции, отражающие превращения тиамина под действием щелочи.
• Что такое тиохромная проба? Объясните ее химический механизм, охарактеризуйте условия проведения, специфичность и чувствительность. Укажите значение данной реакции для контроля качества ЛС.
• Перечислите возможные методы количественного определения тиамина хлорида (бромида). Объясните их сущность, напишите уравнения реакций.
• Перечислите ЛС, относящиеся к производным пиримидин-2,4,6-триона. Напишите их структурные формулы, приведите названия по систематической номенклатуре.
• Чем обусловлена лактим-лактамная таутомерия производных пиримидина?
• Охарактеризуйте кислотно-основные свойства производных пиримидина. Как проявляются эти свойства при идентификации и количественном определении лекарственных веществ данной группы?
• Чем обусловлена способность барбитуратов вступать в реакцию комплексообразования с солями тяжелых металлов?
• Решите задачу.
Rp: Barbitali 0,1 Glucosi 0,3 M.f.p.
D.t.d. № 20
S. По 1 порошку 2 раза в день.
■ Для количественного определения содержания барбитала 50 мг препарата растворили в 2 мл спирта, нейтрализованного по смешанному индикатору (тимоловый синий + фенолфталеин), и оттитровали 0,1 моль/л раствором NaOH до сине-фиолетового окрашивания.
■ Напишите уравнение реакции, соответствующей количественному определению.
■ Рассчитайте титр соответствия и объем рабочего раствора Vтеор.
■ В соответствии с приказом № 305 от 16.10.1997 г. «О нормах отклонений, допустимых при изготовлении ЛС и фасовке промышленной продукции в аптеках» рассчитайте интервал допустимых отклонений от прописанной массы действующего вещества.
■ Правильно ли приготовлена лекарственная форма, если на титрование навески порошка был затрачен объем рабочего раствора V = 0,71 мл?
Не нашли, что искали? Воспользуйтесь поиском: