
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
МОЛЕКУЛЯРНАЯ ФИЗИКА. ГАЗОВЫЕ ЗАКОНЫ
Основные понятия, законы и формулы
1.1. Количество вещества – число структурных элементов (молекул, атомов, ионов и т.п.), содержащихся в теле или системе. Количество вещества выражается в молях. Моль равен количеству вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в нуклиде 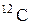 массой 0,0012 кг.
массой 0,0012 кг.
Количество вещества однородного газа:
 или
или  ,
,
где  – число молекул газа в данном объеме;
– число молекул газа в данном объеме;  – постоянная Авогадро (число молекул в одном моле),
– постоянная Авогадро (число молекул в одном моле),  ;
;  – масса газа;
– масса газа;  – молярная масса.
– молярная масса.
Если система представляет смесь нескольких газов, то количество вещества системы:


или
 ,
,
где  ,
,  ,
,  ,
, 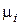 – соответственно количество вещества, число молекул, масса, молярная масса
– соответственно количество вещества, число молекул, масса, молярная масса 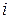 – ой компоненты системы (
– ой компоненты системы ( ).
).
1.2. Молярная масса смеси газов:
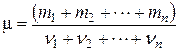 ,
,
где  – масса
– масса 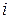 – го компонента смеси;
– го компонента смеси;  – количество вещества
– количество вещества 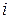 -го компонента,
-го компонента,  – число компонентов смеси.
– число компонентов смеси.
1.3. Массовая доля 
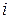 – го компонента смеси газа (в долях единицы или процентах):
– го компонента смеси газа (в долях единицы или процентах):
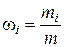 ,
,
где  – масса смеси;
– масса смеси;  – масса
– масса 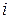 – го компонента.
– го компонента.
1.4. Концентрация молекул:
 ,
,
где  – число молекул, содержащихся в объеме
– число молекул, содержащихся в объеме  системы;
системы; 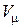 – объем одного моля (
– объем одного моля ( );
);  – плотность вещества.
– плотность вещества.
Формула справедлива не только для газов, но и для любого агрегатного состояния вещества.
1.5. Уравнение состояния идеального газа (уравнение Менделеева - Клапейрона):
 или
или 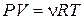 ,
,
где  – масса газа;
– масса газа;  – молярная масса газа;
– молярная масса газа;  – молярная (универсальная) газовая постоянная;
– молярная (универсальная) газовая постоянная;  – термодинамическая температура;
– термодинамическая температура;  – количество вещества.
– количество вещества.
1.6. Опытные газовые законы, являющиеся частными случаями уравнения Менделеева-Клапейрона для изопроцессов:
· закон Бойля-Мариотта (изотермический процесс,  ,
,  ):
):

или для двух состояний газа
 ;
;
· закон Гей-Люссака (изобарический процесс,  ,
,  ):
):

или для двух состояний
 ;
;
· закон Шарля (изохорический процесс,  ,
,  ):
):

или для двух состояний
 .
.
1.7. Зависимость давления от концентрации молекул и температуры:
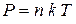 ,
,
где  – постоянная Больцмана;
– постоянная Больцмана;  – концентрация молекул;
– концентрация молекул;  – термодинамическая температура.
– термодинамическая температура.
1.8. Закон Дальтона – давление смеси идеальных газов равно сумме парциальных давлений входящих в неё газов:
 ,
,
где  – парциальное давление
– парциальное давление 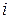 – го компонента смеси;
– го компонента смеси;  – число компонентов смеси.
– число компонентов смеси.
Парциальное давление – давление, которое оказал бы компонент смеси, если бы он один занимал объем, равный объему смеси при той же температуре.
1.9. Барометрическая формула, выражающая убывание давления газа с высокой 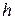 над поверхностью Земли:
над поверхностью Земли:
 ,
,
где  – давление на высоте
– давление на высоте 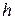 ;
;  – давление на высоте
– давление на высоте  ;
;  – абсолютная температура;
– абсолютная температура;  – ускорение свободного падения.
– ускорение свободного падения.
Не нашли, что искали? Воспользуйтесь поиском: