
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
ОСНОВЫ ТЕРМОДИНАМИКИ
Основные понятия, законы и формулы
5.1. Первое начало термодинамики:
 ,
,
где 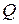 – количество теплоты, сообщенное системе или отданное ею;
– количество теплоты, сообщенное системе или отданное ею;  – изменение ее внутренней энергии;
– изменение ее внутренней энергии;  – работа системы против внешних сил.
– работа системы против внешних сил.
5.2. Первое начало термодинамики для малого изменения состояния системы:
 ,
,
где  – бесконечно малое изменение внутренней энергии системы;
– бесконечно малое изменение внутренней энергии системы;  – элементарная работа;
– элементарная работа;  – бесконечно малое количество теплоты. В этом выражении
– бесконечно малое количество теплоты. В этом выражении  является полным дифференциалом, а
является полным дифференциалом, а  и
и  таковыми не являются.
таковыми не являются.
5.3. Удельная теплоемкость измеряется количеством теплоты, необходимой для нагревания единицы массы вещества на один кельвин:
 .
.
5.4. Молярная теплоемкость измеряется количеством теплоты, необходимой для нагревания одного моля вещества на один кельвин:
 .
.
5.5. Связь между удельной и молярной теплоемкостями газа:
 ,
,
где  – молярная масса газа.
– молярная масса газа.
5.6. Молярные теплоемкости газа при постоянном объеме и постоянном давлении:
 ,
,  ,
,
где 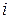 – число степеней свободы.
– число степеней свободы.
5.7. Уравнение Майера:
 .
.
5.8. Внутренняя энергия идеального газа:
 .
.
5.9. Работа, совершаемая газом при элементарном изменении объёма газа:
 .
.
 5.10. Полная работа
5.10. Полная работа  , совершаемая газом при изменении его объёма от
, совершаемая газом при изменении его объёма от  до
до  :
:
 .
.
5.11. Графическое изображение работы. При увеличении объёма на  совершаемая газом работа
совершаемая газом работа  численно равна площади затонированной полоски.
численно равна площади затонированной полоски.
Полная работа, совершаемая газом при расширении от объема  до объёма
до объёма  численно равна площади фигуры, ограниченной осью абсцисс, кривой зависимости давление
численно равна площади фигуры, ограниченной осью абсцисс, кривой зависимости давление  от объёма
от объёма  и двумя изохорами
и двумя изохорами  и
и 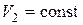 (рис.3).
(рис.3).
5.12. Работа идеального газа в политропических процессах:
· при изобарическом процессе
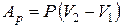 или
или  ;
;
· при изотермическом процессе
 или
или  ;
;
· при изохорическом процессе
 ;
;
· при адиабатном процессе

или
 ,
,
где  – отношение молярных (или удельных) теплоемкостей газа при постоянном давлении и постоянном объёме.
– отношение молярных (или удельных) теплоемкостей газа при постоянном давлении и постоянном объёме.
5.13. Уравнение адиабатного процесса (уравнение Пуассона):
 ,
,  ,
, 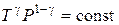 ,
,
где  – показатель адиабаты.
– показатель адиабаты.
5.14. Коэффициент полезного действия для кругового процесса (цикла):
 ,
,
где  – количество теплоты, получаемое рабочим веществом;
– количество теплоты, получаемое рабочим веществом;  – отдаваемое количество теплоты;
– отдаваемое количество теплоты;  – работа, совершаемая за цикл рабочим веществом.
– работа, совершаемая за цикл рабочим веществом.
5.15. Термический КПД цикла Карно, состоящего из двух изотерм и двух адиабат:
 ,
,
где  – количество теплоты, полученное газом при изотермическом расширении при температуре нагревателя
– количество теплоты, полученное газом при изотермическом расширении при температуре нагревателя  ;
;  – количество теплоты, отданное газом при изотермическом сжатии при температуре холодильника
– количество теплоты, отданное газом при изотермическом сжатии при температуре холодильника  .
.
5.16. Энтропия – функция термодинамического состояния системы:
 ,
,
где  – элементарное количество теплоты, сообщаемое системе при малом изменении ее состояния;
– элементарное количество теплоты, сообщаемое системе при малом изменении ее состояния;  – температура, при которой было получено это количество теплоты.
– температура, при которой было получено это количество теплоты.
5.17. Изменение энтропии системы в любом обратимом процессе, переводящем её из состояния 1 в состояние 2:
 .
.
5.18. Второе начало термодинамики: энтропия замкнутой системы при любых происходящих в ней процессах не уменьшается – она возрастает при необратимых процессах и остается постоянной в случае обратимых процессов, т.е.
 .
.
5.19. Связь между энтропией 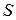 и статистическим весом
и статистическим весом  (термодинамической вероятностью):
(термодинамической вероятностью):
 ,
,
где 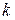 – постоянная Больцмана.
– постоянная Больцмана.
Статистический вес макросостояния – это число различных микросостояний, соответствующих данному макросостоянию.
РЕАЛЬНЫЕ ГАЗЫ
Основные понятия, законы и формулы
6.1. Уравнение состояния реального газа (уравнение Ван-дер-Ваальса):
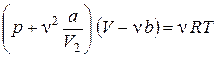 ,
,
где  – число молей,
– число молей,  и
и  – постоянные Ван-дер-Ваальса, различные для разных газов (их значения берутся из таблицы 4 в приложениях).
– постоянные Ван-дер-Ваальса, различные для разных газов (их значения берутся из таблицы 4 в приложениях).
6.2. Внутреннее давление, обусловленное силами взаимодействия молекул:
 .
.
6.3. Собственный объем молекул:
 .
.
6.4. Соотношения между параметрами критического состояния и постоянными Ван-дер-Ваальса:
 ;
;  ;
;  ,
,
где  – молярный критический объём газа;
– молярный критический объём газа;  и
и  – его критические давление и температура.
– его критические давление и температура.
6.5. Внутренняя энергия моля ван-дер-ваальсовского газа:
 ,
,
где  – молярная теплоемкость идеального газа при постоянном объеме;
– молярная теплоемкость идеального газа при постоянном объеме; 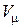 – молярный объём;
– молярный объём;  – поправка Ван-дер-Ваальса на силы межмолекулярного притяжения.
– поправка Ван-дер-Ваальса на силы межмолекулярного притяжения.
ЖИДКОСТИ
Основные понятия, законы и формулы
7.1. Поверхностная энергия (добавочная энергия, которую имеют молекулы, лежащие в поверхностном слое жидкости, по сравнению с молекулами внутри жидкости):
 ,
,
где 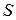 – площадь поверхности жидкости;
– площадь поверхности жидкости;  – коэффициент поверхностного натяжения.
– коэффициент поверхностного натяжения.
7.2. Коэффициент поверхностного натяжения измеряется силой поверхностного натяжения, действующей на единицу длины любого контура, ограничивающего поверхность жидкости:
 .
.
Силы поверхностного натяжения  лежат в плоскости, касательной к поверхности жидкости, и перпендикулярны к элементу контура
лежат в плоскости, касательной к поверхности жидкости, и перпендикулярны к элементу контура  .
.
7.3. Формула Лапласа:
 ,
,
где 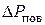 – избыточное давление (поверхностное давление), создаваемое в жидкости вследствие кривизны поверхности жидкости;
– избыточное давление (поверхностное давление), создаваемое в жидкости вследствие кривизны поверхности жидкости;  и
и  – радиусы кривизны двух взаимно перпендикулярных нормальных сечений поверхности жидкости. При этом
– радиусы кривизны двух взаимно перпендикулярных нормальных сечений поверхности жидкости. При этом 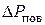 положительно, если поверхность жидкости выпуклая, и отрицательно, если – вогнутая. В случае сферической поверхности избыточное давление равно
положительно, если поверхность жидкости выпуклая, и отрицательно, если – вогнутая. В случае сферической поверхности избыточное давление равно

 .
.
7.4. Высота подъема жидкости в капилляре:
 ,
,
где  – краевой угол (угол между касательными к поверхности жидкости и твердого тела);
– краевой угол (угол между касательными к поверхности жидкости и твердого тела); 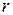 – радиус капилляра;
– радиус капилляра;  – плотность жидкости;
– плотность жидкости;  – ускорение свободного падения;
– ускорение свободного падения;  – радиус кривизны изогнутой поверхности жидкости – мениска (рис. 4).
– радиус кривизны изогнутой поверхности жидкости – мениска (рис. 4).
7.5. Высота поднятия жидкости в капилляре радиуса 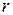 при полном смачивании:
при полном смачивании:
 .
.
7.6. Высота подъема жидкости между двумя близкими и параллельными плоскостями:
 ,
,
где  – расстояние между плоскостями.
– расстояние между плоскостями.
7.7. Уравнение Клапейрона-Клаузиуса:
 ,
,
где  – удельная теплота фазового перехода;
– удельная теплота фазового перехода;  и
и 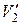 – удельные объёмы фазы
– удельные объёмы фазы  и фазы
и фазы 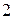 (объемы единицы массы,
(объемы единицы массы,  );
);  – температура перехода (процесс изотермический).
– температура перехода (процесс изотермический).
Не нашли, что искали? Воспользуйтесь поиском: