
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Розрахунки складу та концентрації складових у сировині.
Концентрація – величина, що характеризує кількісний склад розчину.
Згідно з правилами ІЮПАК концентрацією розчиненої речовини (не розчину) називають відношення кількості розчиненої речовини або його маси до об’єму розчину (моль/л, г/л), тобто це співвідношення неоднорідних величин.
Ті величини, які є відношенням однотипних величин (відношення маси розчиненої речовини до маси розчину, відношення об’єму розчиненої речовини до об’єму розчину) правильно називати долями. Проте на практиці для обох видів виразу складу застосовують термін «концентрація» й говорять про концентрацію розчинів.
Існує багато способів виразу концентрації розчинів.
Масова частка – відношення маси розчиненої речовини до маси розчину. Масова частка вимірюється в долях одиниці:
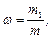
де m 1 – маса розчиненої речовини, г (кг);
m – загальна маса розчину, г (кг).
Об’ємна частка – відношення об’єму розчиненої речовини до об’єму розчину. Об’ємна частка вимірюється в долях одиниці або у відсотках:
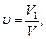
де V 1 – об’єм розчиненої речовини, л;
V – загальний об’єм розчину, л.
Існують ареометри, призначені для визначення концентрації розчинів певних речовин. Такі ареометри проградуйовані не в значеннях щільності, а безпосередньо концентрації розчину. Для поширених розчинів етилового спирту, концентрація яких зазвичай виражається в об’ємних відсотках, такі ареометри отримали назву спиртомірів або андрометрів.
Молярність (молярна об’ємна концентрація) – кількість розчиненої речовини (число молів) в одиниці об’єму розчину. Молярна концентрація в системі СІ вимірюється в моль/м3, проте на практиці її набагато частіше виражають у моль/л або ммоль/л. Також поширений вираз «молярність». Можливе інше позначення молярної концентрації – С(х), яке прийнято позначати М. Так, розчин з концентрацією 0,5 моль/л називають 0,5-молярним.
Примітка: термін «моль» не відміняється. Після цифри пишуть «моль», подібно до того, як після цифри пишуть «см», «кг» і т. д.

де v – кількість розчиненої речовини, моль;
V – загальний об’єм розчину, л.
Моляльність (молярна вагова концентрація) – кількість розчиненої речовини (число молів) в 1 000 г розчинника. Вимірюється в моль на кг, також поширений вираз «моляльність». Так, розчин з концентрацією 0,5 моль/кг називають 0,5-моляльним.

де v – кількість розчиненої речовини, моль;
m 2 – маса розчинника, кг.
Слід звернути особливу увагу, що, на схожість назв, молярна концентрація й моляльність – величини різні. Перш за все, на відміну від молярної концентрації, при виразі концентрації в моляльності розрахунок ведуть на масу розчинника, а не на об’єм розчину. Моляльність, на відміну від молярної концентрації, не залежить від температури.
Нормальна концентрація (молярна концентрація еквівалента) – кількість еквівалентів певної речовини в 1 л розчину. Нормальну концентрацію виражають в моль∙екв/л або г∙екв/л (мається на увазі моль еквівалентів). Для запису концентрації таких розчинів використовують скорочення «н» або «N». Наприклад, розчин, що містить 0,1 моль/л, називають децинормальним і записують як 0,1 н.
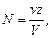
де v – кількість розчиненої речовини, моль;
V – загальний об’єм розчину, л;
z – фактор еквівалентності.
Нормальна концентрація може відрізнятися залежно від реакції, у якій бере участь речовина. Наприклад, одномолярный розчин H2SO4 буде однонормальним, якщо він призначається для реакції з лугом з утворенням гідросульфату KHSO4, і двонормальним у реакції з утворенням K2SO4.
Титр розчину – маса розчиненої речовини в 1 мл розчину.
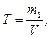
де m 1 – маса розчиненої речовини, г;
V – загальний об’єм розчину, мл.
В аналітичній хімії концентрацію титранту зазвичай перераховують стосовно конкретної реакції титрування так, щоб об’єм використаного титранта безпосереднього показував масу визначуваної речовини; тобто титр розчину показує, якій масі визначуваної речовини (у грамах) відповідає 1 мл розчину, що титрує.
Мольна частка – відношення кількості молів певного компоненту до загальної кількості молів усіх компонентів. Мольну частку виражають у долях одиниці:
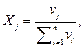
де vi – кількість i -го компоненту, моль;
n – кількість компонентів;
Існують й інші поширені в певних областях знань або технологіях, методи виразу концентрації. Наприклад, у фотометрії часто використовують масову концентрацію, що дорівнює масі розчиненої речовини в 1 л розчину. Під час приготування розчинів кислот часто вказують, скільки об’ємних частин води припадає на одну об’ємну частину концентрованої кислоти (наприклад, 1: 3). Концентрація забруднень у повітрі може виражатися в частинах на мільйон (ppm). Іноді використовують також відношення мас (відношення маси розчиненої речовини до маси розчинника) і відношення об’ємів (аналогічно, відношення об’єму речовини, що розчиняється, до об’єму розчинника).
Не нашли, что искали? Воспользуйтесь поиском: