
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Проведение слияния миеломных клеток и лимфоцитов с целью получения гибридных клеток
Мышей отобранных для слияния обездвиживали методом цервикальной дислокации. После этого проводили обработку кожного покрова 70% спиртом, препарировали кожу и не нарушая целостности капсулы извлекали селезенку, и отмывали ее три раза в неполной ростовой среде. Селезенку помещали в чашку Петри и вымывали из нее спленоциты (лимфоциты) неполной ростовой средой путем перфузии (рисунок 5).

Рисунок 5. Вымывание спленоцитов из селезенки
Полученные спленоциты центрифугировали при 1000 об/мин в течение 10 минут, осадок клеток ресуспендировали в неполной ростовой среде и проводили подсчет клеток в камере Горяева по следующей методики:
Для определения количества живых клеток, 40 мкл суспензии смешивали с равным количеством 0,4% раствора трипана синего в PBS. Небольшой объем смеси вносили под покровное стекло камеры Горяева и считали количество клеток в двух «квадратах».
Гибридизацию лимфоцитов мышей с миеломными клетками проводили в присутствии 45% раствора ПЭГ-4000. Для культивирования клеточных культур использовали среду RPMI-1640 с добавлением 10% фетальной сыворотки плода коровы, 0,05 мг/л пирувата натрия, 0,003 мл/л 2-меркаптоэтанола. Получение антиидиотипических антител проводили по схеме представленной на рисунке 6.
Гибридные клетки культивировали в обычном режиме, применяемом для клеточных культур: при температуре 37°С и 5% содержанием СО2.
Через 24 часа в каждую ячейку планшета добавляли равное количество среды, содержащей гипоксантин, аминоптерин, тимидин (ГАТ) в двукратной концентрации. Рост гибридных клеток в лунках планшеты учитывали, начиная с 7-10 суток после слияния. Культуральную жидкость из лунок, в которых зафиксирован рост клеток, тестировали в ИФА на наличие содержания специфических антител. В лунки, из которых была отобрана культуральная среда, добавляли равное количество полной ростовой среды, содержащей гипоксантин и тимидин (ГТ). Далее культивирование проводили только на полной ростовой среде. Тестирование гибридом на антительную продуктивность начинали проводить, когда наблюдалось незначительное пожелтение ростовой среды и клетки гибридом занимали более 30% поверхности лунок.
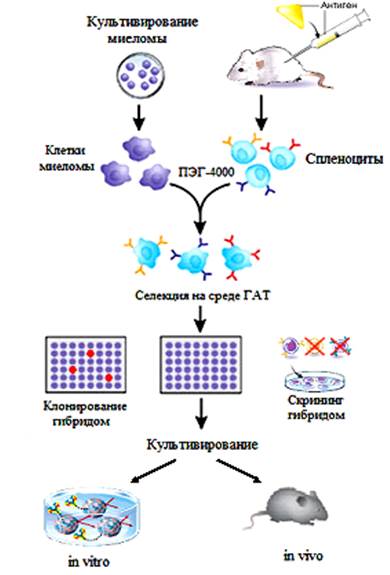
Рисунок 6. Схема получения антиидиотипических антител
В результате двух слияний миеломных клеток и иммунных лимфоцитов было получено10 гибридомобладающих способностью к росту в селективной среде ГАТ (таблица 4).
Таблица 4 – Результаты гибридизации миеломных клеток со спленоцитами мышей, иммунизированных коъюгированным препаратом МКА+БСА
| № гибри-дизации | Количество засеянных лунок | Соотношение миеломных клеток и спленоцитов | Образование клонов (гибридом) | Выход гибридом – продуцентов АИТ | |
| Количество | % | ||||
| 1:10 | 1,6 | ||||
| 1:3 | 3,1 |
Результаты слияний, представленные в таблице 4, показывают, что в первом случае выход клонов составил 1,6%, рост клонов наблюдался только в 6 лунках. Низкий процент слившихся клеток повлиял на выход клонов-продуцентов АИТ к конъюгированному препарату. Проведение второго слияния дало положительные результаты, и выход клонов составил 3,1%. Важным аспектом полученного результата является соотношение миеломных клеток и спленоцитов, которое составило при проведении второй гибридизации 1:3. Также следует отметить, что увеличение числа гибридом возрастает по мере увеличения продолжительности культивирования (таблица 5).
Таблица 5 – Выход гибридных клеток в зависимости от продолжения культивирования
| Количество суток после гибридизации | Количество образовавшихся клонов | Выход клонов, % |
| 7 сутки | 1,6 | |
| 11 сутки | 2,08 | |
| 14 сутки | 2,9 | |
| 19 сутки | 3,1 |
Данные таблицы 5 показывают, что при продолжении культивирования увеличивается выход клонов. Процент выхода клонов составляет от 1,6 до 3,1%, что указывает на оптимизацию процесса во втором слиянии.
Не нашли, что искали? Воспользуйтесь поиском: