
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Распределение электронов в многоэлектронных атомах
Важнейшей характеристикой электрона в атоме является энергия притяжения его ядром, или, что то же самое, энергия связи электрона с ядром, или кратко "энергия электрона".
В атоме водорода энергия притяжения электрона ядром (протоном) в расчёте на 1 моль составляет –1312 кДж[40], или –13,6 эВ на 1 атом.
Энергии притяжения электрона атомным ядром приписывается знак минус, так как она пропорциональна силе, определяемой произведением величин притягивающихся зарядов, знаки которых противоположны.
E ~ F, 
Заряд ядра атома гелия в 2 раза больше заряда ядра атома водорода, значит, и энергия притяжения электрона ядром в атоме гелия больше. Но поскольку два электрона, имеющиеся в атоме гелия, отталкиваются друг от друга, тоэнергия их связи с ядром меньше (по модулю) удвоенной энергии связи электрона в атоме водорода и составляет –2372 кДж/моль, или 24,6 эВ на 1 атом. За счёт увеличения этой энергии происходит подтягивание электронов к атомному ядру, поэтому область пространства, в котором движутся электроны атома Не, то есть 1 s -орбиталь, сжимается. Радиус сферы, в которой в основном состоянии атома Не находятся электроны, равен 29 пм. Таким образом, радиус атома Н (46 пм) больше радиуса атома Не в 1,59 раза[41].
Следующий по сложности строения – атом лития, имеющий три электрона. Два из них занимают 1 s -орбиталь, как и электроны в атомах Не (только эта орбиталь ещё сильнее, чем у атома гелия, сжата около ядра, рис. 22), а третьего электрона здесь согласно запрету Паули быть не может. Поэтому третий электрон находится на другой орбитали, которая также представляет собой сферу, только значительно бόльшего радиуса (155 пм).
Энергия связи третьего электрона с атомным ядром намного меньше (по модулю), чем первых двух электронов, находящихся к ядру ближе: значения этих энергий составляют –513 и –7298 кДж/моль соответственно. В этом случае говорят, что третий электрон находится на s -подуровне второго энергетического уровня, или на 2s-орбитали.
В атоме следующего за литием элемента – бериллия имеется четыре электрона: два изних в основном состоянии атома занимают 1 s -орбиталь и два – 2 s -орбиталь. По сравнению с атомом Li атом Be (r = 113 пм) меньше, так как обладает бόльшим зарядом ядра, которое сильнее, чем ядро атома лития, притягивает электроны, энергия которых равна – 503 кДж/моль) (рис. 22).



 r а, пм: 46 29 155 113
r а, пм: 46 29 155 113
Рис. 22. Сечения 1s- и 2s-электронных облаков атомов водорода, гелия, лития и бериллия плоскостями, проходящими через их ядра
Таким образом, в атоме бериллия 1 s - и 2 s -орбитали оказываются целиком занятыми, поэтому у атома следующего элемента – бора, пятый электрон должен занять новую орбиталь.
На каждом энергетическом уровне атомов (кроме первого) имеется по три р -орбитали. Поэтому всего на втором энергетическом уровне атомов может находиться не более восьми электронов (два электрона на 2 s -орбитали и по два электрона на каждой из трёх 2 р -орбиталей).
р -Орбитали атомов следующих за бериллием элементов: бора В, углерода С, …, вплоть до неона Ne, в основном состоянии последовательно заполняются электронами согласно правилу Хунда.
Распределение электронов в атоме по энергетическим уровням и подуровням называется электронной конфигурацией (электронным строением) атома. Она выражается электронной формулой, в которой цифрами обозначаются энергетические уровни атома, а подуровни – буквами, справа от которых надстрочным индексом указывается число электронов на данном подуровне. Например, распределение электронов в электронейтральном атоме хлора в основном состоянии можно выразить полной и сокращённой электронными формулами:
Cl l s 22 s 22 p 63 s 23 p 53 d 0 и Cl [Ne] 3 s 23 p 5.
Полная электронная формула указывает, что на первом энергетическом уровне, то есть на 1 s -подуровне атома хлора находятся два электрона; на втором уровне на s -подуровне – два электрона и на р -подуровне – шесть электронов; на третьем уровне на s -подуровне – два электрона и на p -подуровне пять электронов, а на d -подуровне электронов нет. Сокращённая электронная формула указывает, что заполнение электронами первого и второго энергетических уровней в атоме хлора происходит аналогично заполнению их в атоме неона, что обозначается его символом в квадратных скобках.
Электронно-графическая формула атома показывает распределение электронов по орбиталям, которые сгруппированы с учётом их энергий в уровни и подуровни.
Если у атомов разных химических элементов одна и та же электронная конфигурация, то они называются изоэлектронными. Например, электронные конфигурации отрицательно заряженных атомов (анионов) серы S2–, хлора Cl–, электронейтрального атома аргона Ar, положительно заряженных атомов (катионов) калия К+ и кальция Са2+ в невозбуждённом состоянии описываются одной и той же электронной формулой l s 22 s 22 p 63 s 23 p 6.
Химические свойства атомов элементов определяются в основном электронным строением их внешних (или и предвнешних) энергетических уровней, называемых валентными. Соответственно, электроны, находящиеся на этих уровнях, также называются валентными. Можно предсказать изменение валентности1 атомов элементов в результате перехода их в возбуждённое состояние, когда электроны распариваются и переходят на более высокий энергетический подуровень.
Схема заполнения электронами энергетических уровней и подуровней, а также орбиталей в многоэлектронных атомах в основном состоянии представлена на рис. 23.

Рис. 23. Последовательность заполнения электронами энергетических уровней и подуровней, а также орбиталей в многоэлектронных атомах
Возбуждённый атом –это атом,получивший дополнительную энергию (рис. 24), в результате чего происходит, как правило, распаривание электронов и переход их на более высокий энергетический подуровень, либо спаривание электронов или изменение их типа на обратный.

Рис. 24. Нормальное и возбуждённое состояния атома
Рассмотрим распределение электронов при переходе из основного, или нормального, в возбуждённое состояние.
Пример. Составьте электронную формулу и изобразите графически схему заполнения электронами валентных орбиталей электронейтрального атома кремния в основном и в возбуждённом состояниях.
Решение. Электронная формула атома кремния в основном состоянии – 1 s 22 s 22 p 63 s 23 p 2. Валентными орбиталями в атоме кремния являются орбитали внешнего энергетического уровня: 3 s, 3 p, 3 d. Схема заполнения электронами этих орбиталей:
Si 
Суммарный спин электронов при их размещении на 3 р -подуровне в соответствии с правилом Хунда имеет максимальное значение, равное 1.
Другие возможные варианты размещения электронов на 3 р -подуровне:

отвечают нулевому значению суммарного спина и, следовательно, соответствуют возбуждённому состоянию атома.
При получении кванта количества энергии (hν) один из 3 s -электронов атома кремния может перейти на вакантную 3 р -орбиталь. При этом энергия атома Si возрастёт так, что электронной конфигурации, которая соответствует одному из возможных возбуждённых его состояний, будет отвечать электронно-графическая формула 3 s 13 p 3:
Si* 
Рассмотрим валентные возможности атомов фосфора в основном и возбуждённом состояниях (атом в возбуждённом состоянии обозначают символом соответствующего химического элемента со звёздочкой):
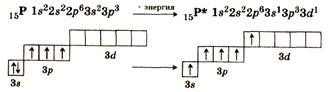
В основном состоянии в атоме фосфора имеется три неспаренных электрона на р -подуровне. При переходе атома в возбуждённое состояние один из пары электронов s -подуровня может переходить на свободную орбиталь d -подуровня. Валентность атома фосфора при этом увеличивается с трёх до пяти.
Распаривание электронов требует затраты энергии, которая, однако, компенсируется энергией, выделяющейся при образовании химических связей с участием неспаренных электронов.
Так, например, атом углерода в основном состоянии имеет два неспаренных электрона, которые способны участвовать в образовании двух химических связей. Однако во многих неорганических и большинстве органических соединений химические связи образует четырёхвалентный атом углерода, находящийся в возбуждённом состоянии.

1s22s22p2 1s22s12p3
Затрата энергии на возбуждение атома углерода с избытком компенсируются энергией, выделяющейся при образовании двух дополнительных химических связей. Так, для перехода атомов углерода из основного состояния 2s22p2 в возбуждённое – 2s12p3 требуется около 400 кДж/моль энергии. При образовании же связи С–Н выделяется 360 кДж/моль. Следовательно, при образовании двух связей С–Н выделится энергия, превышающая энергию перехода атомов углерода в возбуждённое состояние на 320 кДж/моль.
Не нашли, что искали? Воспользуйтесь поиском: