
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
УПРАЖНЕНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
1. В атомах каких наиболее распространённых в природе нуклидов соответственно содержится 1, 4, 7 и 14 нуклонов?
2. Какова относительная атомная масса химического элемента, ядра атомов которого состоят из 76 протонов и 114 нейтронов?
Что это за элемент?
3. Сколько протонов, нейтронов и электронов содержат электронейтральные атомы нуклидов 79Br и 81Br?
4. На основании относительной атомной массы таллия, равной 204,38 а.е.м., рассчитайте его изотопный состав, если в природе существуют нуклиды 203Tl и 205Tl.
5. Вычислите относительную атомную массу кремния, изотопное содержание которого в природных химических соединениях следующее:
28Si – 92,28, 29Si – 4,67 и 30Si – 3,05 % (по массе).
6. Чем различаются атомные орбитали:
а) 2s и 3s; б) 4s и 4p?
Чем могут различаться 4d-орбитали?
7. Выпишите значения квантовых чисел для валентных электронов атомов (основное состояние) Na, C, P, Ca, Se и Ar.
8. Составьте электронную формулу атомов химического элемента (в основном состоянии), в которых электроны внешнего энергетического уровня имеют следующие значения квантовых чисел:
n = 5; l = 0; ml = 0; ms = +1/2 и –1/2.
Что это за химический элемент?
9. Сколько электронов со значением m l = 0 содержится в электронейтральном атоме марганца в основном состоянии?
10. У атомов какого химического элемента:
а) заканчивается заполнение электронами энергетического 4 d -подуровня;
б) начинается заполнение электронами 4 р -подуровня.
11. Укажите последовательность заполнения электронами атомных орбиталей, характеризующихся суммой п и l, равной 5 (а); 6 (б) и 7 (в).
12. Определите, в каком порядке в атоме будут заполняться электронами энергетические подуровни 4d, 4f, 5s, 5p и 5d.
13. Из четырёх электронов, находящихся на энергетическом p -подуровне атома, сколько имеют одинаковые значения спина и чему равен их суммарный спин?
14. Какие атомы изоэлектронны: Mg2+, Na+, Si4+, P3–?
15. Укажите не менее четырёх ионов, электронные конфигурации которых совпадают с электронной конфигурацией атома аргона в основном состоянии.
16. Составьте электронные формулы атомов B, P, Mg, Cl, Fe, Ge и Se. Чему равно число неспаренных электронов у атомов этих элементов?
17. Составьте электронную формулу электронейтрального атома химического элемента с зарядом ядра:
а) 8; б) 13; в) 18; г) 23; д) 53; е) 63; ж) 83
в основном состоянии и изобразите графически распределение его валентных электронов.
18. Укажите, какие электронные конфигурации атомов химических элементов невозможны и объясните, почему:
1 р 3 (а); 3 р 6 (б); 3 s 2 (в); 2 s 2 (г); 2 d 5 (д); 5 f 2 (e); 3 d 12 (ж);
2 р 4 (з) и 3 р 7 (и).
19. Электронному строению атомов какого химического элемента соответствует сокращённая электронная формула:
а) 5 s 25 p 4; б) 3 d 54 s 1; в) 3 d 64 s 2?
20. Составьте электронные формулы ионов:
Fe2+, Fe3+, Sc3+, Be2+, P3–, Cl– и О2–.
21. Сколько вакантных 3 d -орбиталей имеется в невозбуждённом атоме:
а) Р; б) V; в) Мn?
22. Сколько неспаренных электронов имеется в основном состоянии атома:
а) В; б) S; в) As; г) Сr; д) Hg; e) Еu?
23. Укажите особенности электронных конфигураций электронейтральных атомов меди и хрома в основном состоянии.
24. В основном состоянии электронейтральных атомов какого химического элемента распределение электронов по энергетическим уровням описывается набором цифр:
а) 2, 8, 6; б) 2, 8, 18, 18, 4; в) 2, 8, 18, 32, 12, 2?
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
1. Какие открытия в области естествознания в конце XIX в. привели учёных к выводу о сложном строении атома? Ответ может включать информацию об экспериментах Беккереля с урановыми рудами и фотопластинками, открытии рентгеновских лучей, обнаружении катодных лучей.
2. Какие модели строения атома были предложены в начале XX в.?
Охарактеризуйте каждую из них, используя рисунки 7, 10.
3. Почему на рисунке 7 в конце спирали стоит вопросительный знак?
4. За счёт чего достигается электронейтральность атомов?
5. Могут ли атомы разных химических элементов при каком-либо условии иметь одинаковые значения массовых чисел?
6. Что называется атомной орбиталью?
Какие формы имеют s-, p-, d-орбитали?
Объясните физический смысл изображений атомных орбиталей:
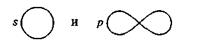
а) поверхность равной электронной плотности, внутри которой заключена произвольная часть электронного облака;
б) траектория движения электрона;
в) поверхность, внутри которой заключено электронное облако;
г) поверхность равной электронной плотности, внутри которой заключена определённая часть электронного облака.
7. Чем отличаются понятия "электронное облако" и "атомная орбиталь"?
8. Каков физический смысл каждого из квантовых чисел? Какие значения они принимают?
9. Укажите, какие наборы квантовых чисел являются разрешёнными:
| а | б | в | г | ||
| n | = | ||||
| l | = | ||||
| m | = | –1 |
10. Какой энергетический подуровень заполняется раньше:
а) 5 s или 4 p; б) 6 d или 7 s; в) 3 s или 3 p;
г) 4 s или 5 s; д) 3 d или 4 p?
Почему?
11. Как определяется максимальное число электронов на энергетическом уровне?
12. Как максимальное число атомных орбиталей энергетического уровня зависит от главного квантового числа?
Сколько орбиталей имеется на четвёртом энергетическом уровне атомов?
13. Форма атомной орбитали связана некоторой зависимостью с энергией электрона. Сформулируйте эту зависимость, сравнив формы s - и p -орбиталей.
14. Из приведённых графических схем для основного энергетического состояния атомов химического элемента:
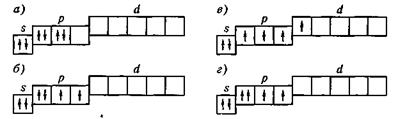
правильной является схема …, потому что: в схеме … нарушено правило Хунда; в схеме … нарушен принцип Паули; в схеме … нарушен принцип минимума энергии.
Не нашли, что искали? Воспользуйтесь поиском: